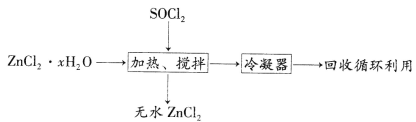
题目内容
【题目】下列情况会使所配溶液浓度偏低或其它测量值偏低的是( )
①滴定实验中配制标准碱液时,所用砝码生锈
②用滴定管量取a.00mL液体时,开始时平视读数,结束时俯视读数
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤
④在用标准液(已知浓度)滴定未知溶液时,标准液滴定管水洗未润洗
⑤定容时,仰视容量瓶的刻度线
⑥在用标准液(已知浓度)滴定未知溶液时,滴定前无气泡滴定后有气泡
⑦滴定前有气泡,滴定终点无气泡
⑧用蒸馏水洗净锥形瓶后盛入待测NaOH溶液进行滴定
A. ①③⑤⑥B. ①②⑤⑦C. ②③④⑧D. ③④⑤⑥
【答案】A
【解析】
①配制标准碱液时,所用砝码生锈,所称碱的质量增大,即所配溶液的浓度偏高,滴定实验中,利用c(待)=![]() ,消耗标准液体积减小,所测未知液的浓度偏低,故①符合题意;
,消耗标准液体积减小,所测未知液的浓度偏低,故①符合题意;
②用滴定管量取a.00mL液体时,开始时平视读数,结束时俯视读数,所量取的液体体积偏高,故②不符合题意;
③溶液转移到容量瓶后,烧杯及玻璃棒未用蒸馏水洗涤,造成容量瓶中溶质的物质的量减小,即所配溶液的浓度偏低,故③符合题意;
④标准液滴定管水洗未润洗,稀释标准液,消耗标准液的体积偏大,故④不符合题意;
⑤定容时,仰视容量瓶的刻度线,所加水的体积偏大,浓度偏低,故⑤符合题意;
⑥滴定前无气泡滴定后有气泡,导致标准液的体积偏低,未知溶液的浓度偏低,故⑥符合题意;
⑦滴定前有气泡,滴定终点无气泡,消耗标准液的体积偏高,未知溶液的浓度偏高,故⑦不符合题意;
⑧用蒸馏水洗净锥形瓶后盛入待测NaOH溶液进行滴定,NaOH物质的量不变,对实验结果无影响,故⑧不符合题意;
综上所述选项A正确;
答案选A。

 捷径训练检测卷系列答案
捷径训练检测卷系列答案 小夫子全能检测系列答案
小夫子全能检测系列答案【题目】某工厂对制革工业污泥中Cr元素的回收与再利用工艺如下(硫酸浸取液中金属离子主要是Cr3+,其次是Fe3+、Fe2+、Al3+、Ca2+、Mg2+):
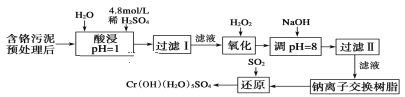
常温下部分阳离子以氢氧化物形式沉淀时溶液的pH见表:
阳离子 | Fe3+ | Fe2+ | Mg2+ | Al3+ | Cu2+ | Cr3+ |
开始沉淀时的pH | 1.9 | 7.0 | - | - | 4.7 | - |
沉淀完全时的pH | 3.2 | 9.0 | 11.1 | 8 | 6.7 | 9(>9溶解) |
(1)酸浸时,为了提高浸取率可采取的措施是___(写一条即可)。
(2)调pH=8是为了除去___(填Fe3+、Al3+、Ca2+、Mg2+)。
(3)试配平氧化还原反应方程式:_Na2Cr2O7+_SO2+_H2O=________Cr(OH)(H2O)5SO4+_Na2SO4;每生成1molCr(OH)(H2O)5SO4消耗SO2的物质的量为___。
(4)印刷电路铜板腐蚀剂常用FeCl3。腐蚀铜板后的混合溶液中,若Cu2+、Fe3+和Fe2+的浓度均为0.10mol/L,请参照上表给出的数据和提供的药品,简述除去CuCl2溶液中Fe3+ 和Fe2+的实验步骤:①___;②___;③过滤。(提供的药品:Cl2、浓H2SO4、NaOH溶液、CuO、Cu)。