题目内容
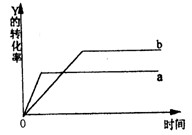
反应 X(气)+ Y(气) 2Z(气);△H=Q(Q<0)在一定条件下,反应物Y的转化率与反应时间(t)的关系如下图所示。若使曲线a变为曲线b可采取的措施是
2Z(气);△H=Q(Q<0)在一定条件下,反应物Y的转化率与反应时间(t)的关系如下图所示。若使曲线a变为曲线b可采取的措施是
 2Z(气);△H=Q(Q<0)在一定条件下,反应物Y的转化率与反应时间(t)的关系如下图所示。若使曲线a变为曲线b可采取的措施是
2Z(气);△H=Q(Q<0)在一定条件下,反应物Y的转化率与反应时间(t)的关系如下图所示。若使曲线a变为曲线b可采取的措施是
| A.加催化剂 | B.降低温度 | C.增大压强 | D.增大Y的浓度 |
B
A 错误 催化剂只能改变平衡达到的时间,不能改变反应物的转化率
B正确降低温度,平衡右移,Y的转化率增大,而温度越低反应速率越慢,达平衡所需时间越长
C 错误该反应为气体体积数不变的反应,故增大压强只能加快反应速率,缩短达平衡所需时间,不能改变反应物的专化率
D增大Y的浓度,可提高X的转化率,而自身的转化率会减小
B正确降低温度,平衡右移,Y的转化率增大,而温度越低反应速率越慢,达平衡所需时间越长
C 错误该反应为气体体积数不变的反应,故增大压强只能加快反应速率,缩短达平衡所需时间,不能改变反应物的专化率
D增大Y的浓度,可提高X的转化率,而自身的转化率会减小

练习册系列答案
相关题目

 CH3CH2OH(g)+H2O(g)
CH3CH2OH(g)+H2O(g)
 2NO(g)+ O2(g),能说明该反应已达化学平衡状态的是
2NO(g)+ O2(g),能说明该反应已达化学平衡状态的是 4NO(g)+6H2O(g),下列叙述正确的是
4NO(g)+6H2O(g),下列叙述正确的是 2C(g)ΔH<0。
2C(g)ΔH<0。 X(g)+Y(?) ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是
X(g)+Y(?) ΔH ,在t1时刻反应达到平衡,在t2时刻缩小容器体积,t3时刻再次达到平衡状态后未再改变条件。下列有关说法中不正确的是
 cC(g)+dD(g),C物质的浓度(c%)与温度、压强的关系如图所示,下列判断正确的是 ( )
cC(g)+dD(g),C物质的浓度(c%)与温度、压强的关系如图所示,下列判断正确的是 ( )
 体积为1 L的密闭容器中,发生如下反应:
体积为1 L的密闭容器中,发生如下反应: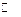 B(g) + xC(?),(正反应放热)。经t min后反应达到平衡,此时A的转化率为a,容器内压强变为原来的(1+1.5a)倍,则下列说法中正确的是( )
B(g) + xC(?),(正反应放热)。经t min后反应达到平衡,此时A的转化率为a,容器内压强变为原来的(1+1.5a)倍,则下列说法中正确的是( )