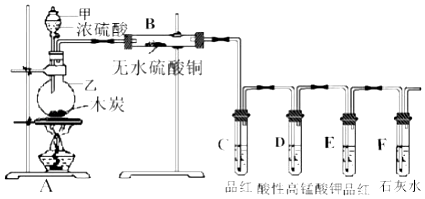
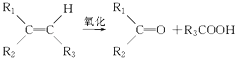
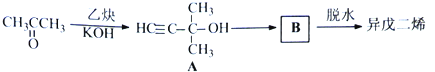��Ŀ����
����Ŀ��ij��Һ�п��ܺ�������6�������е�ij���֣�Cl�� ![]() ��
�� ![]() ��
�� ![]() ��K+��Na+��Ϊȷ����Һ��ɽ�������ʵ�飺
��K+��Na+��Ϊȷ����Һ��ɽ�������ʵ�飺
��200 mL������Һ����������BaCl2��Һ����Ӧ�������ˡ�ϴ�ӡ�����ó���4.30 g��������м�����������ᣬ��2.33 g�������ܡ�
����ٵ���Һ�м���������NaOH��Һ�����ȣ������ܴ�ʹʪ���ɫʯ����ֽ��������
��1.12 L(�ѻ���ɱ�״�����ٶ�����������ȫ���ݳ�)��
��1����Һһ�����ڵ������� �� ���ܴ��ڵ���������
��2��ԭ��Һ��c( ![]() )Ϊ �� c(
)Ϊ �� c( ![]() )c(
)c( ![]() ) (���������=��)��
) (���������=��)��
��3���������6�����Ӷ����ڣ���c(Cl)c( ![]() ) (���������=��)��
) (���������=��)��
���𰸡�
��1��![]() ��
�� ![]() ��
�� ![]() ,Cl?��K+��Na+
,Cl?��K+��Na+
��2��0.05 mol/L,��
��3����
����������ȡ��������Һ����BaCl2��Һ�а�ɫ�������ɣ��ټ�������������������ܽ⣬�����������ɣ�˵����ɫ����ΪBaCO3��BaSO4������һ����4.3 g������Һ�к��� ![]() ��
�� ![]() ��������м�����������ᣬ��2.33 g�������ܣ������ᱵ��������2.33 g��������������ӵ����ʵ�����
��������м�����������ᣬ��2.33 g�������ܣ������ᱵ��������2.33 g��������������ӵ����ʵ����� ![]() =0.01 mol������̼�ᱵ��������4.3 g2.33 g=1.97 g��
=0.01 mol������̼�ᱵ��������4.3 g2.33 g=1.97 g�� ![]() �����ʵ�����
�����ʵ����� ![]() =0.01 mol������ٵ���Һ�м���������NaOH��Һ�����ȣ�������ʹʪ���ɫʯ����ֽ�����������ǰ��������ʵ�����
=0.01 mol������ٵ���Һ�м���������NaOH��Һ�����ȣ�������ʹʪ���ɫʯ����ֽ�����������ǰ��������ʵ����� ![]() =0.05 mol��˵����Һ����
=0.05 mol��˵����Һ���� ![]() �����ʵ�����0.05 mol���ۺ����Ϸ�����(1)��Һһ�����ڵ������У�
�����ʵ�����0.05 mol���ۺ����Ϸ�����(1)��Һһ�����ڵ������У� ![]() ��
�� ![]() ��
�� ![]() �����ܴ��ڵ������У�Cl��K+��Na+��(2)���ݼ���ó�c(
�����ܴ��ڵ������У�Cl��K+��Na+��(2)���ݼ���ó�c( ![]() )=
)= ![]() =0.05 mol/L��
=0.05 mol/L�� ![]() Ϊ0.01 mol��
Ϊ0.01 mol�� ![]() Ϊ0.05 mol����c(
Ϊ0.05 mol����c( ![]() )��c(
)��c( ![]() )��(3)������Һ������ԭ���趼���ڣ���ô0.05 mol+n(Na+)+n(K+)=2��0.01 mol+2��0.01 mol+n(Cl-)���ݴ˵ó�n(Cl)=n(Na+)+n(K+)+0.01 mol��0.01 mol��
)��(3)������Һ������ԭ���趼���ڣ���ô0.05 mol+n(Na+)+n(K+)=2��0.01 mol+2��0.01 mol+n(Cl-)���ݴ˵ó�n(Cl)=n(Na+)+n(K+)+0.01 mol��0.01 mol��
����ʵ������ͳ������ӵļ��鷽���������������е������ж���Һ��һ�����ڵ����ӡ����ܴ��ڵ����ӵȼ���.

 ����ͼ���������������ϵ�д�
����ͼ���������������ϵ�д� ����ѧҵ���Ե�����ϵ�д�
����ѧҵ���Ե�����ϵ�д�����Ŀ������Ӫ��ƽ�⣬����ʹ��ҩ���DZ�֤���Ľ��������������������Ч�ֶΣ�
��1������������ɵ����ʵĻ����ṹ��Ԫ���������һ�����еĹ������ǰ�������NH2���� ��д�ṹ��ʽ����
��2�����������ϰ�����Ӫ��ȱ��֢������Ҫ��������ȡ ��������ʡ���֬���������ࡱ����������ģ�����ʳ���и��������ʵ��� ��������ĸ����
A������B�������� C������D������
��3����ͼ��ʾ4֧�Թ�ͬʱˮԡ����4min��Ϊ�������е��۵�ˮ��̶ȣ�ijͬѧ��ʵ������������¼���£�
��� | ���� | ���� |
1 | �����ˮ | ��Һ�����ɫ |
2 | ����������Һ��ˮԡ���� | δ�������� |
3 | �����ˮ | ��Һ�����ɫ |
4 | ����������Һ��ˮԡ���� | δ�������� |
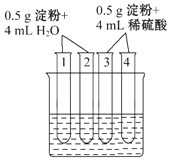
����Թ�1��2�е����ó��Ľ���������֧�Թ��е��� ˮ�⣨�û�С������֡���ȫ������������Թ�3��4�е������ܵó�������֧�Թ��е���û��ˮ�⡱�Ľ��ۣ�������