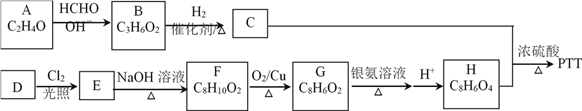
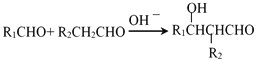题目内容
【题目】甲烷、甲醇都是清洁能源。
(1)已知下列热化学方程式
①CO2(g)+3H2(g)=CH3OH(g) +H2O (g)△H= -49.0 kJ/mol
②CH4(g)+2O2(g)=2H2O(g) +CO2(g) △H= -802.3 kJ/mol
③2H2(g)+O2(g)=2H2O(l) △H=-571.6 kJ/mol
④H2O(g)=H2O(l) △H= -44.0 kJ-mol
则CH4(g)+1/2O2(g)=CH3OH(g) △H =____________。
(2)工业上合成甲醇的另一种方法是2H2(g)+CO(g) ![]() CH3OH(g) △H。
CH3OH(g) △H。
一定温度下在3个体积均为1.0 L的恒容密闭容器中发生上述反应,相关物理量见下表:
容器 | 温度/K | 物质的起始浓度/molL-1 | 物质的平衡浓度/mol.L-1 | ||
c(H2) | c(CO) | c(CH3OH) | c(CH3OH) | ||
I | 400 | 0.20 | 0.10 | 0 | 0.080 |
II | 400 | 0.40 | 0.20 | 0 | |
III | 500 | 0 | 0 | 0.10 | 0.025 |
①该反应的△H______0(填“>”或“<”)。
②达到平衡时,容器I中c(CH3OH)_____0.16mol/L(填“>” “<” 或“=”)。
③400 K 时该反应的平衡常数K=________。
(3)文献报道某课题组利用CO2催化缺化制甲烷的研究过程如下:
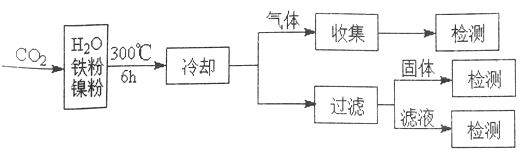
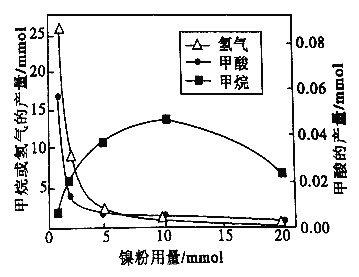
反应结束后,气体中检测到CH4和H2,滤液中检测到HCOOH,固体中检测到镍粉和Fe3O4。CH4、HCOOH、H2 的产量和镍粉用量的关系如下图所示(仪改变镍粉用量,其他条件不变)。研究人员根据实验结果得出结论:HCOOH 是CO2转化为CH4 的中间体,即:![]()
①写出产生H2的反应方程式_________。
②由图可知,镍粉是_______(填字母)。
a.反应I的催化剂 b.反应II 的催化剂
c.反应I和II的催化剂 d.不是催化剂
③当镍粉用量从1mmol增加到10mmol,反应速率的变化情况是______(填字母)。
a.反应1的速率增加,反应II的速率不变
b.反应I的速率不变,反应II的速率增加
c.反应I、II的速率均不变
d.反应I、II的速率均增加,且反应I的速率增加得快
e.反应I、II的速率均增加,且反应II 的速率增加得快
f.反应I的速率减小,反应II的速率增加
【答案】 -125.9kJ/mol < > 2.5×103(L/mol)2 3Fe+4H2O ![]() Fe3O4+4H2 c e
Fe3O4+4H2 c e
【解析】(1)考查热化学反应方程式的计算,①+②-③×3/2+④×3得出:CH4(g)+1/2O2(g)=CH3OH(g) △H=-125.9kJ·mol-1;(2)考查勒夏特列原理、化学平衡的计算,①对比I和III,升高温度,甲醇的物质的量浓度降低,根据勒夏特列原理,正反应方向是放热反应,即△H<0;②II在I的基础上再通入0.2mol·L-1H2和0.1mol·L-1CO,相当于在I的基础上增大压强,平衡向正反应方向移动,即c(CH3OH)>0.16mol·L-1;③
2H2(g)+CO(g) ![]() CH3OH(g)
CH3OH(g)
起始:0.2 0.1 0
变化:0.16 0.08 0.08
平衡:0.04 0.02 0.08,K=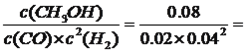 2500;(3)考查影响化学反应速率的因素,①根据信息得到氢气和Fe3O4,显然是铁在高温下与水蒸气发生反应得到氢气,即化学反应方程式为3Fe+4H2O
2500;(3)考查影响化学反应速率的因素,①根据信息得到氢气和Fe3O4,显然是铁在高温下与水蒸气发生反应得到氢气,即化学反应方程式为3Fe+4H2O ![]() Fe3O4+4H2;②根据信息,反应前后均有镍粉,从图像上看,随着镍粉的用量不同,曲线的走势不同,即反应的快慢不同,满足催化剂的条件,故选项c正确;③从图像上分析,当镍粉用量从1nmol增加到10nmol,H2和HCOOH的量均快速减少,即反应速率增大,由于甲酸的量变化较快,则说明反应速率II较快,故选项e正确。
Fe3O4+4H2;②根据信息,反应前后均有镍粉,从图像上看,随着镍粉的用量不同,曲线的走势不同,即反应的快慢不同,满足催化剂的条件,故选项c正确;③从图像上分析,当镍粉用量从1nmol增加到10nmol,H2和HCOOH的量均快速减少,即反应速率增大,由于甲酸的量变化较快,则说明反应速率II较快,故选项e正确。

【题目】下表是几种弱酸常温下的电离平衡常数:
CH3COOH | H2CO3 | H2S | H3PO4 |
1.8×10-5 | K1=4.3×10-7 | K1=9.1×10-8 | K1=7.5×10-3 |
则下列说法中不正确的是( )
A.碳酸的酸性强于氢硫酸
B.多元弱酸的酸性主要由第一步电离决定
C.常温下,加水稀释醋酸, ![]() 增大
增大
D.向弱酸溶液中加少量NaOH溶液,电离常数不变
【题目】CO2是一种廉价的碳资源,其综合利用具有重要意义。CO2与CH4经催化重整,制得合成气:CH4(g)+CO2(g)![]() 2CO(g)+2H2(g)。
2CO(g)+2H2(g)。
(1)已知上述反应中相关的化学键键能数据如下:
化学键 | C-H | C=O | H-H | C≡O(CO) |
键能/kJ·mol-1 | 413 | 745 | 436 | 1075 |
则该反应的△H=______kJ·mol-1。
(2)为了加快该反应的速率,可以进行的措施是(_____)。
A.恒温恒压下,按原比例充入CH4、CO2
B.恒温下,缩小容器体积
C.增大反应物与催化剂的接触面积
D.降低温度
(3)恒温下,向2L体积恒定的容器中充入一定量的CO2、CH4,使其在催化剂作用下进行反应,经tmin后,测得CO有amol,则v(CO2)=______。下列各项能说明该反应达到平衡的是(______)。
A.容器内气体密度保持一定 B.容器内CO2、CH4的浓度之比为1∶1
C.该反应的正反应速率保持一定 D.容器内气体压强保持一定
(4)用甲烷作燃料的碱性燃料电池中,电极材料为多孔惰性金属电极,则负极的电极反应式为_______________。