题目内容
下列离子或分子在溶液中能大量共存,通入CO2后仍能大量共存的一组是
| A.K+、Na+、Br—、SiO32— | B.H+、Fe2+、SO42—、Cl2 |
| C.K+、Ba2+、Cl—、NO3— | D.K+、Ag+、NH3·H2O、NO3— |
C
解析试题分析:A.因碳酸的酸性比硅酸强,所以向B组通入二氧化碳,必发生反应CO2+SiO32-+H2O=H2SiO3↓+CO32-,所以A组不能大量共存,故A错误;B.该组微粒中氯气具有强氧化性,二价铁离子具有还原性,2Fe2++Cl2=2Fe3++2Cl-,所以B组不能大量共存,故B错误;C.该组离子不反应,能大量共存,溶液中,通入CO2后CO2+H2O?H2CO3,H2CO3?H++HCO3-,HCO3-?H++CO32-,溶液中存在大量的氢离子、碳酸根离子与K+、Na+、Cl-、NO3-,均不反应,也能大量共存,故C正确;D.该组微粒中Ag++NH3?H2O=AgOH↓+NH4+,AgOH+2NH3?H2O=[Ag(NH3)2]++OH-+2H2O,所以D组不能大量共存,故D错误;故选C.
考点:离子共存问题,解题的关键在于:掌握离子不能共存的原因,平时学习应多注意积累一些特殊的反应.解答该题注意二氧化碳与水反应的产物与溶液中的离子共存,题目难度中等。

下列物质的水溶液能导电,但属于非电解质的是
| A.NH3 | B.Cl2 | C.C2H5OH | D.CH3COOH |
下列离子方程式正确的是
| A.大理石溶于醋酸: CaCO3+2H+ =Ca2+ + CO2 ↑ +H2O |
| B.FeBr2溶液中通入少量的Cl2: Cl2+2Fe2+=2Fe3+ +2Cl- |
| C.向NaHSO4溶液中滴加Ba(OH)2至刚好沉淀完全:2H++SO42- +Ba2+ +2OH- = BaSO4 ↓+ ↑2H2O |
| D.酸性氢氧燃料电池的正极反应: H2-2e- = 2H+ |
能正确表示下列各组溶液混合后,所得液体恰好呈中性的离子方程式是
| A.Ba(OH)2和NaHSO4:Ba2+ +2OH— +2H+ +SO42—→BaSO4↓+ 2H2O |
| B.Ba(OH)2和NaHSO4:Ba2+ + OH—+ H++ SO42—→BaSO4↓+ H2O |
| C.Ba(OH)2和KAl(SO4)2:2Ba2++ 4OH—+ Al3++ 2SO42—→2BaSO4↓+ AlO2— |
| D.Ba(OH)2和KAl(SO4)2:3Ba2+ + 6OH—+ 2Al3++ 3SO42—→3BaSO4↓+2Al(OH)3↓ |
下表中的离子方程式及评价都合理的是( )
| 编号 | 化学反应 | 离子方程式 | 评 价 |
| A | 碳酸钙与醋酸反应 | CO32-+2CH3COOH= CO2↑+H2O+2CH3COO- | 错误。碳酸钙是弱电解质,不应写成离子形式 |
| B | NaHSO3的水解 | HSO3-+H2O SO32-+H3O+ SO32-+H3O+ | 错误。水解方程式误写成电离方程式 |
| C | 苯酚钠溶液中通入少量CO2 | C6H5O-+CO2+H2O→ CO 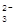 +C6H5OH +C6H5OH | 正确 |
| D | 等物质的量的 FeBr2和Cl2反应 | 2Fe2+ +2Br-+2Cl2= 2Fe3++Br2+4Cl- | 错误。Fe2+与Br-的物质的量之比与化学式不符 |
某工业废水含有下列离子中的5种(不考虑水的电离及离子的水解),K+、Cu2+、Al3+、Fe2+、Cl-、CO32-、NO3-、SO42-,且各种离子的物质的量浓度相等。甲同学欲探究废水的组成,进行了如下实验:
①用铂丝蘸取少量溶液,在火焰上灼烧,透过蓝色钴玻璃观察无紫色火焰。
②另取溶液加入足量稀盐酸,有无色气体生成,该无色气体遇空气变成红棕色,此时溶液依然澄清,且溶液中阴离子种类不变。
③另取溶液加入BaCl2溶液,有白色沉淀生成。
根据上述实验,以下推测正确的是( )
| A.溶液中难以确定Al3+的存在与否 |
| B.原溶液中所含的离子为:Cu2+、Fe2+、Cl-、NO3-、SO42- |
| C.步骤②中可以确定Fe2+、NO3-的存在,不能确定其它离子的存在 |
| D.步骤③中的白色沉淀为2种钡盐 |
下列离子方程式正确的是
| A.向AlCl3溶液中滴加氨水:Al3++3OH-=Al(OH)3↓ |
| B.向NaHCO3溶液中加入少量Ca(OH)2溶液:HCO3-+Ca2++OH-=CaCO3↓+H2O |
C.向苯酚溶液中滴加Na2CO3溶液: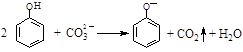 |
| D.向氯化亚铁溶液中滴加稀硝酸:3Fe2++4H++ NO3-= 3Fe3++NO↑+2H2O |
下列化学过程及其表述正确的是 ( )
| A.向NaHSO4溶液中滴入Ba(OH)2溶液至中性H++SO42-+Ba2++OH-=BaSO4↓+H2O |
| B.由水电离的c(H+)为10-3 mol·L-1的溶液中,Na+、NO3-、SO32-、Cl-一定能大量共存 |
| C.向含有1molKAl(SO4)2的溶液中加入Ba(OH)2溶液至沉淀质量最大时,沉淀的总的物质的量为2mol |
| D.可以用浓盐酸酸化的KMnO4溶液与H2O2混合,以证明H2O2具有还原性2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
下列离子方程式表达的反应事实正确的是
| A.Fe3O4与稀硝酸反应:Fe3O4+8H+=2Fe3++Fe2++4H2O |
| B.向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42-=BaSO4↓ |
| C.向碳酸钙中加入稀盐酸:CO32-+2H+=CO2↑+H2O |
| D.向Ca(ClO)2溶液中通入过量二氧化碳:ClO-+ H2O + CO2=" HClO" + HCO3- |