题目内容
4.I.下列实验操作或对实验事实的描述中,正确的是①③(填序号).①用量筒量取稀硫酸溶液8.0mL;
②Fe(OH)3胶体与FeCl3溶液的混合物可用过滤的方法分离;
③用湿润的pH试纸测量某溶液pH时,测量值可能比真实值小;
④用碱式滴定管量取KMnO4溶液20.50mL;
⑤在实验室中用锌和稀硫酸反应制氢气,为加快反应速率而不影响H2的品质,可向溶液中加适量Cu(NO3)2晶体.
Ⅱ.将某98%的浓硫酸样品敞口露置于空气中,放置24h后,取出5mL浓硫酸与18mL 9 mol•L-1的NaOH溶液恰好完全中和.请回答下列问题:
(1)该硫酸样品露置24h后,其物质的量浓度是16.2mol•L-1.
(2)若分别用下列方法鉴别浓硫酸和稀硫酸,可以达到目的是bd(填序号).
a.常温下加入铜片 b.常温下加入铁片
c.常温下加入木炭 d.用玻璃棒各蘸取少许涂在滤纸上
(3)工业上利用过量氨水吸收硫酸工业尾气中的有害物质,请写出该过程中发生的一个反应的离子方程式SO2+2NH3•H2O=SO32-+2NH4++H2O或SO3+2NH3•H2O=SO42-+2NH4++H2O.
分析 I.①量筒的感量为0.1mL;
②胶体与溶液均可透过滤纸;
③湿润的pH试纸,测定碱溶液的pH会偏小;
④KMnO4能氧化橡胶;
⑤加适量Cu(NO3)2晶体,Zn、氢离子、硝酸根离子发生氧化还原反应不生成氢气;
Ⅱ.(1)恰好完全中和,则2n(硫酸)=n(NaOH),结合n=cV计算;
(2)浓硫酸和稀硫酸均为酸溶液,但浓硫酸具有吸水性、脱水性及强氧化性;
(3)过量氨水吸收硫酸工业尾气中的有害物质,与二氧化硫反应生成亚硫酸铵,与三氧化硫反应生成硫酸铵.
解答 解:I.①量筒的感量为0.1mL,则可用量筒量取稀硫酸溶液8.0mL,故正确;
②胶体与溶液均可透过滤纸,则过滤不能分离,故错误;
③湿润的pH试纸,测定碱溶液的pH会偏小,测NaCl溶液的pH不变,测酸溶液的pH偏大,故正确;
④KMnO4能氧化橡胶,则应利用酸式滴定管量取KMnO4溶液20.50mL,故错误;
⑤加适量Cu(NO3)2晶体,Zn、氢离子、硝酸根离子发生氧化还原反应不生成氢气,则应加氯化铜或硫酸铜,故错误;
故答案为:①③;
Ⅱ.(1)恰好完全中和,则2n(硫酸)=n(NaOH),则硫酸的物质的量浓度是$\frac{0.018L×9mol/L}{2×0.005L}$=16.2mol/L,故答案为:16.2;
(2)a.常温下加入铜片,均不反应,不能鉴别,故错误;
b.常温下加入铁片,稀硫酸反应生成气体,现象不同,可鉴别,故正确;
c.常温下加入木炭,均不反应,不能鉴别,故错误;
d.用玻璃棒各蘸取少许涂在滤纸上,浓硫酸能使滤纸碳化,现象不同,可鉴别,故正确;
故答案为:bd;
(3)过量氨水吸收硫酸工业尾气中的有害物质,与二氧化硫反应生成亚硫酸铵,与三氧化硫反应生成硫酸铵,离子反应为SO2+2NH3•H2O=SO32-+2NH4++H2O或SO3+2NH3•H2O=SO42-+2NH4++H2O,故答案为:SO2+2NH3•H2O=SO32-+2NH4++H2O或SO3+2NH3•H2O=SO42-+2NH4++H2O.
点评 本题考查化学实验方案的评价,为高频考点,涉及物质的性质、物质的量计算、实验操作及实验技能等,把握反应原理、实验细节等为解答的关键,侧重分析与实验能力的考查,注意实验的评价性分析,题目难度不大.

| A. | 提高反应物的浓度 | B. | 使用合适的催化剂 | ||
| C. | 降低温度 | D. | 增大压强 |
| A. | 麦芽糖 | B. | 淀粉 | C. | 果糖 | D. | 核糖 |
| A. | 高纯度的硅单质广泛用于制作光导纤维 | |
| B. | 在汽车排气管上加装“催化转化器”是为了减少有害气体的排放 | |
| C. | 开发利用各种新能源,减少对化石燃料的依赖,可以降低空气中PM2.5的含量 | |
| D. | 严格执行“限塑令”是解决“白色污染”问题的重要途径 |
| A. | 氧气和臭氧 | B. | 乙烷和乙烯 | ||
| C. | 氕、氘和氚 | D. | 正戊烷、异戊烷和新戊烷 |
| A. | Ba(NO3)2─→BaSO4 | B. | H2SO4─→HCl | C. | CuO─→Cu(OH)2 | D. | Ba(OH)2─→Fe(OH)3 |
| A. | 9a/b mol-1 | B. | 9b/a 1mol-1 | C. | b/a mol-1 | D. | a/bmol- |
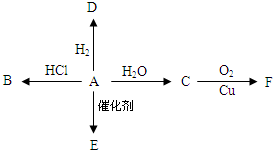 如图所示,已知有机物A的产量可以衡量一个国家的石油化工发展水平,A可以发生如图一系列的反应,按要求回答下列问题
如图所示,已知有机物A的产量可以衡量一个国家的石油化工发展水平,A可以发生如图一系列的反应,按要求回答下列问题