题目内容
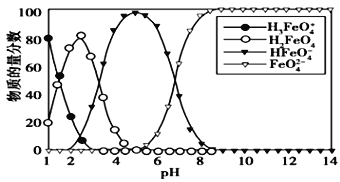
【题目】某混合物浆液含少量Na2CrO4,考虑到胶体的吸附作用使Na2CrO4不易完全被水浸出,某研究小组利用设计的电解分离装置,使浆液分离成固体混合物和含铬元素溶液,并回收利用。已知:阴极池中得到NaOH和H2,阳极池中得到含有Cr2O72-和CrO42-的混合溶液。

(1)用惰性电极电解时,CrO42-能从浆液中分离出来的原因是____________________。
(2)离子交换膜I属于________________(填“阳膜”或“阴膜”),阳极的电极反应方程式为___。生成Cr2O72-的原因____________(离子反应方程式和必要的文字解释)。
【答案】 在直流电场作用下,CrO42-通过阴离子交换膜向阳极室移动,脱离浆液 阳膜 4OH--4e-=2H2O+O2↑(或2H2O-4e-= O2 ↑+ 4H+) OH-放电后,阳极池酸度增强,发生反应2CrO42-+2H+= Cr2O72-+H2O
【解析】试题分析:本题考查电解原理应用于物质的分离。
(1)在电解池中阳离子向阴极移动,阴离子向阳极移动,用惰性电极电解时,在直流电场作用下,CrO42-通过阴离子交换膜向阳极室移动,脱离浆液而从浆液中分离出来,从而在阳极池中得到含有Cr2O72-和CrO42-的混合溶液。
(2)根据离子的放电顺序,阴极的电极反应式为:2H++2e-=H2↑,阴极附近水电离的H+浓度减小,水的电离平衡正向移动,H+继续在阴极放电,阴极附近c(OH-)![]() c(H+),阴极池中得到NaOH和H2,则离子交换膜I属于阳膜。阳极的电极反应式为:4OH--4e-=O2↑+2H2O,阳极附近水电离的OH-浓度减小,水的电离平衡正向移动,OH-继续在阳极放电,阳极附近c(H+)
c(H+),阴极池中得到NaOH和H2,则离子交换膜I属于阳膜。阳极的电极反应式为:4OH--4e-=O2↑+2H2O,阳极附近水电离的OH-浓度减小,水的电离平衡正向移动,OH-继续在阳极放电,阳极附近c(H+)![]() c(OH-),阳极池酸度增强,发生反应2CrO42-+2H+=Cr2O72-+H2O,CrO42-转化为Cr2O72-。
c(OH-),阳极池酸度增强,发生反应2CrO42-+2H+=Cr2O72-+H2O,CrO42-转化为Cr2O72-。