题目内容
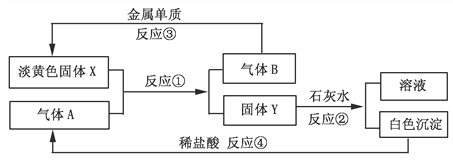
【题目】降低发动机中柴油燃烧产生NOx的排放,可利用尿素分解产生的气体采用选择性催化还原技术或储存还原技术来消除污染。
(1)选择性催化还原技术工作原理为:

①尿素[CO(NH2)2]水溶液热分解为NH3和CO2,该反应的化学方程式_________。
②用2Kg尿素能处理标准状况下含NOx(以NO2计)体积分数为7%的尾气10m3,则该尿素的利用率为_____________。
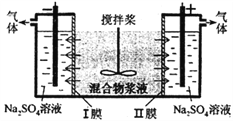
③将上述尾气处理原理设计成原电池,在处理了废气的同时产生电能,其工作原理如图所示。则通入NH3的一极为_______________极,通入NOx时发生的电极反应方程式为___________。
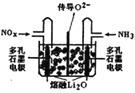
(2)储存还原技术工作原理为:NOx的储存和还原在不同时段交替进行,如图所示。
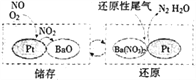
①写出上图中储存NO时发生的反应总方程式________________________。
②还原过程中,有时会产生笑气(N2O)。用同位素示踪法研究发现笑气的产生与NO有关。在有氧条件下15NO与NH3以一定比例反应时,得到的笑气几乎都是(15N2N)2O3。将该反应的化学方程式补充完整:________![]() 口(15N2N)2O3+口H2O
口(15N2N)2O3+口H2O
【答案】 H2O+CO(NH2)2![]() 2NH3↑+CO2↑ 0.625 负 2NOx +4xe-= N2 +2xO2- 4NO+3O2+2BaO=2Ba(NO3)2 415NO+2NH3+O2
2NH3↑+CO2↑ 0.625 负 2NOx +4xe-= N2 +2xO2- 4NO+3O2+2BaO=2Ba(NO3)2 415NO+2NH3+O2![]() (15N2N)2O3+3H2O
(15N2N)2O3+3H2O
【解析】试题分析:本题以消除NOx的污染为载体,考查化学方程式的书写,化学计算,原电池的工作原理和电极反应式的书写。
(1)①尿素水溶液受热分解生成NH3和CO2,反应的化学方程式为H2O+CO(NH2)2![]() 2NH3↑+CO2↑。
2NH3↑+CO2↑。
②依据题意,尿素热分解产生的NH3将NO2还原为N2消除污染,NH3被氧化成N2,根据得失电子守恒,3n(NH3)=4n(NO2),n(NH3)=![]() n(NO2)=
n(NO2)=![]() =
=![]() mol,则消耗的CO(NH2)2物质的量为
mol,则消耗的CO(NH2)2物质的量为![]() mol,尿素的利用率为
mol,尿素的利用率为![]() mol
mol![]() =0.625。
=0.625。
③该处理过程中NH3发生氧化反应生成N2,通入NH3的一极为原电池的负极。通入NOx的一极为正极,NOx发生还原反应生成N2,N元素的化合价由+2x价降至0价,结合电解质为熔融Li2O,通入NOx的电极的电极反应式为2NOx+4xe-=N2+2xO2-。
(2)①由图可见储存时的反应为:2NO+O2=2NO2、4NO2+O2+2BaO=2Ba(NO3)2,将两式相加消去NO2,得反应的总方程式为4NO+3O2+2BaO=2Ba(NO3)2。
②根据(15N2N)2O3中15N与N物质的量之比为2:1,则15NO与NH3物质的量之比为2:1,15NO得到电子物质的量与NH3失去电子物质的量之比为(2![]() 1):(1
1):(1![]() 4)=1:2,根据得失电子守恒,参与反应的15NO、NH3、O2物质的量之比为4:2:1,结合原子守恒,写出方程式为415NO+2NH3+O2
4)=1:2,根据得失电子守恒,参与反应的15NO、NH3、O2物质的量之比为4:2:1,结合原子守恒,写出方程式为415NO+2NH3+O2![]() (15N2N)2O3+3H2O。
(15N2N)2O3+3H2O。

 导学全程练创优训练系列答案
导学全程练创优训练系列答案