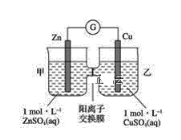
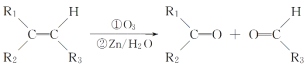
题目内容
【题目】甲醇、氧气和强碱溶液做电解质的手机电池中的反应:2CH3OH+3O2+4OH-![]() 2CO32-+6H2O,有关说法正确的是( )
2CO32-+6H2O,有关说法正确的是( )
A. 放电时,负极电极反应:CH3OH+8OH--6e-=== CO32-+6H2O
B. 放电时,CH3OH参与反应的电极为正极
C. 标况下,通入11.2 L O2完全反应有1 mol电子转移
D. 充电时电解质溶液的pH逐渐减小
【答案】A
【解析】
根据2CH3OH+3O2+4OH-![]() 2CO32-+6H2O知,甲醇失去电子发生氧化反应,所以负极上燃料发生电极反应;氧气得电子发生还原反应,所以正极为氧气得电子发生还原反应,根据电极反应式判断电极附近溶液的PH值变化。
2CO32-+6H2O知,甲醇失去电子发生氧化反应,所以负极上燃料发生电极反应;氧气得电子发生还原反应,所以正极为氧气得电子发生还原反应,根据电极反应式判断电极附近溶液的PH值变化。
A.放电时,负极上甲醇失电子发生氧化反应,甲醇失电子和氢氧根离子反应生成碳酸根离子和水,电极反应式为CH3OH+8OH--6e-═CO32-+6H2O,故A正确;
B.正极上得电子发生还原反应,根据2CH3OH+3O2+4OH-![]() 2CO32-+6H2O知,放电时,氧气参与反应的电极为正极,故B错误;
2CO32-+6H2O知,放电时,氧气参与反应的电极为正极,故B错误;
C.放电时,正极上的电极反应式为:O2+2H2O+4e-═4OH-,通入0.25mol氧气并完全反应后,有1mol电子转移,故C错误;
D. 充电时是电解池的工作原理,生成氢氧根离子,电解质溶液的pH升高,故D错误;
答案选A。

【题目】用中和滴定法测定烧碱的纯度,若烧碱中含有与酸不反应的杂质,试根据实验回答:
(1)将准确称量好的2.0 g烧碱样品配成100mL待测液,需要的主要玻璃仪器除量筒、烧杯、玻璃棒外,还必须用到的仪器有_______、________________。
(2)用碱式滴定管量取10.00mL待测液,置于锥形瓶中,同时滴加1-2滴指示剂。化学上常选用的指示剂有酚酞或____________。
(3)用0.2010mol·L-1标准盐酸滴定待测烧碱溶液,滴定时左手旋转酸式滴定管的玻璃活塞,右手不停地摇动锥形瓶,两眼注视__________________,直到滴定到终点,若选择酚酞作为指示剂,判断滴定终点的标志是___________________________。
(4)根据下列数据,测得c(NaOH)=________。烧碱的纯度=____________。
滴定 次数 | 待测液体积 (mL) | 标准盐酸体积(mL) | |
滴定前读数(mL) | 滴定后读数(mL) | ||
第一次 | 10.00 | 0.50 | 20.40 |
第二次 | 10.00 | 4.00 | 24.10 |
第三次 | 10.00 | 1.00 | 24.10 |
(5)以标准的盐酸溶液滴定未知浓度的氢氧化钠溶液,下列操作引起待测液浓度偏小的是 _______________(填序号)。
①读数:滴定前平视,滴定后俯视②未用待测液润洗碱式滴定管
③用待测液润洗锥形瓶④不小心将标准液滴在锥形瓶外面
⑤滴定接近终点时,用少量蒸馏水冲洗锥形瓶内壁