题目内容
将5.4 g Al 投入到200mL 2.0 mol/L的某溶液中有氢气产生,充分反应后有金属剩余。该溶液可能为
| A.HNO3溶液 | B.Ba(OH)2溶液 | C.H2SO4溶液 | D.HCl溶液 |
D
试题分析:200.0mL 2.0mol?L-1的某溶液中溶质的物质的量为0.2L×2.0mol?L-1=0.4mol,Al的物质的量为5.4g÷27g/mol=0.2mol,A、因Al与HNO3溶液不生成氢气,则不符合题意,故A错误;B、由2Al+2OH-+2H2O=2AlO2-+3H2↑,0.2molAl与0.4molBa(OH)2溶液反应时,碱过量,故B错误;C、由2Al+6H+=2Al3++3H2↑,0.2molAl与0.4molH2SO4溶液反应,硫酸过量,故C错误;D、由2Al+6H+=2Al3++3H2↑,0.2molAl与0.4molHCl溶液反应,Al过量,故D正确,答案选D。

练习册系列答案
 津桥教育计算小状元系列答案
津桥教育计算小状元系列答案
相关题目
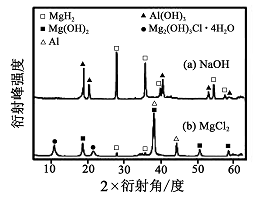
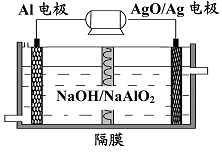

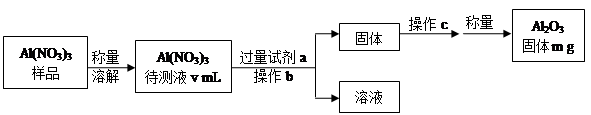





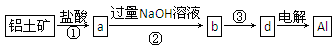
 8Cu+4FeO+2Fe2O3+16SO2
8Cu+4FeO+2Fe2O3+16SO2