题目内容
铝热反应是铝的一个重要性质,该性质用途十分广泛,不仅被用于焊接钢轨,而且还常被用于冶炼高熔点的金属如钒、铬、锰等。



(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是 。
(2)若证明上述所得“铁块”中含有金属铝,可选择 (填试剂名称),所发生反应的离子方程式为 。
(3)为克服图甲的缺陷改用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色。为测定该实验所得 “铁块”的成分,实验流程如图所示。

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
① 试剂A应选择 ,试剂B应选择 。(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
② 已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)= mol·L-1。
③ 灼烧完全的标志是 。
④ 若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是 。如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会 (填“偏大”“偏小”或“无影响”),原因是 。



(1)某校化学兴趣小组同学,取磁性氧化铁按教材中的实验装置(如图甲)进行铝热反应,现象很壮观。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,发现溶液变血红色。出现这种现象的原因,除了可能混有没反应完的磁性氧化铁外,还有一个原因是 。
(2)若证明上述所得“铁块”中含有金属铝,可选择 (填试剂名称),所发生反应的离子方程式为 。
(3)为克服图甲的缺陷改用图乙装置进行铝热反应。取反应后的“铁块”溶于盐酸,向其中滴加KSCN溶液,溶液没有出现血红色。为测定该实验所得 “铁块”的成分,实验流程如图所示。

几种氢氧化物开始沉淀和完全沉淀的pH如下表所示。
| | Fe2+ | Fe3+ | Al3+ | Mg2+ |
| 开始沉淀时的pH | 7.5 | 2.8 | 4.2 | 9.6 |
| 沉淀完全时的pH | 9.0 | 4.0 | 5 | 11 |
① 试剂A应选择 ,试剂B应选择 。(填序号)
A.稀盐酸 B.氧化铁 C.H2O2溶液 D.氨水 E.MgCO3固体
② 已知常温下Fe(OH)3的Ksp=1.1×10-36,则反应Ⅲ后溶液中c(Fe3+)= mol·L-1。
③ 灼烧完全的标志是 。
④ 若最终红色粉未M的质量为12.0 g,则该“铁块”的纯度是 。如果对所得过滤固体直接洗涤、烘干、称量,计算“铁块”的纯度,则计算结果会 (填“偏大”“偏小”或“无影响”),原因是 。
(1)熔融的铁被空气中氧气氧化
(2)氢氧化钠溶液 2Al+2OH-+2H2O=2AlO+3H2↑
(3)C D 1.1×10-6 前后两次灼烧质量相差不大于0.1g 84% 偏小 Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小。
试题分析:(1)根据现象确定溶液中含有铁离子,再根据(3)改进实验结果判定熔融的铁在溅落时被空气中的氧气氧化;(2)需要把铁块中的铝溶解出再鉴别,用氢氧化钠溶液溶解;(3)①该操作的目的是把铁转化为氧化铁,除去杂质,根据氧化铁质量计算铁的纯度,沉淀时亚铁离子不易沉淀,顾需先把其氧化为铁离子再调节pH生成氢氧化铁沉淀;③前后两次灼烧质量相差不大于0.1g;
④红色粉末为氧化铁,则该“铁块”的纯度=12.0÷160×2×56÷10.0=0.84;因为Fe(OH)3在烘干过程中会有部分发生分解反应,质量变小,导致结果偏小。

练习册系列答案
 新活力总动员暑系列答案
新活力总动员暑系列答案 龙人图书快乐假期暑假作业郑州大学出版社系列答案
龙人图书快乐假期暑假作业郑州大学出版社系列答案
相关题目
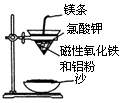
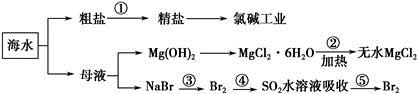
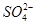 、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸
、Ca2+、Mg2+、Fe3+等杂质,加入的药品顺序为Na2CO3溶液→NaOH溶液→BaCl2溶液→过滤后加盐酸