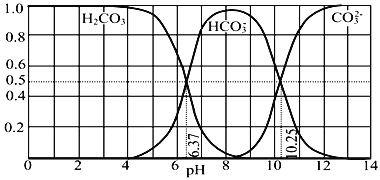
��Ŀ����
����Ŀ����������;�㷺�Ļ���ԭ�ϣ�������ˮ������ˮ�����������ʹ����ȡ�
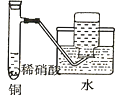
(1)��ϡ���ᡢͭ����������ȡ����ͭ����������Ҫ��������ͼ��ʾ��
ϡ���ᡢͭ����������Ӧ�������漰���ķ�Ӧ�����ӷ���ʽ��______________��������Һ��ͨ���ȿ����ķ�Ӧ�����ӷ���ʽ��__________������Һ�õ���ˮ����ͭ��ʵ�������________��
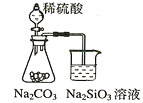
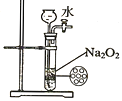
(2)�������������������Ṥҵβ���еĶ�������ͬʱ�Ƶ�����泥���Ҫ�Ĺ�����������ͼ��ʾ��

���������з�����Ӧ�Ļ�ѧ����ʽ��______________________��
�������ݱ���������������Һ��pH��5.5��6.0֮�䣬����Ч�ʽϸߣ�������һ��������β��ʱ��������Һ��pH�ķ�����______��
���𰸡�Fe2O3+6H+=2Fe3++3H2O��2Fe3++Cu=2Fe2++Cu2+ 4Fe2++4H++O2=4Fe3++2H2O �����ᾧ��������ˮ 4NH3H2O+2SO2+O2=2(NH4)2SO4+2H2O ���ڰ�ˮ������������
��������
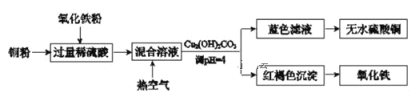
(1)�����������ᷴӦ��������������������ͭ��Ӧ��������ͭ�����������������й����ȵĿ�������Fe2+����ΪFe3+������Cu(OH)2CO3��������Һ��pH=4����Ӧ�������ɫFe(OH)3���������������˳��������ȣ��õ�����Fe2O3����Һ��CuSO4��
(2)���������Ṥҵβ���еĶ�������ͬʱ�Ƶ�����泥���������ͨ�����������������������������Ϊ�����Σ�
������������Һ��pH��5.5��6.0֮�䣬����Ч�ʽϸߡ�������һ��������β��ʱ��������Һ��pH�ķ����ǿ��ư�����������
(1)��������ת��ͼ�����������������ᷴӦ��������������������ͭ��Ӧ��������ͭ��������������Ӧ�����ӷ���ʽΪ��Fe2O3+6H+=2Fe3++3H2O��2Fe3++Cu=2Fe2++Cu2+����ͨ�����������Fe2+ΪFe3+�����ӷ���ʽΪ��4Fe2++4H++O2=4Fe3++2H2O������Cu(OH)2CO3��������ҺpH=4��Fe3+�γ�Fe(OH)3������ȥ���õ�����ͭ��Һ����������Ũ���ᾧ�õ�����ͭ���壬�����������ˮ�õ���ˮ����ͭ��
(2)����������ͼ�������������з�����Ӧ�Ƕ�������һˮ�ϰ���������Ӧ��������狀�ˮ����Ӧ�Ļ�ѧ����ʽΪ��4NH3H2O+2SO2+O2=2(NH4)2SO4+2H2O��
������������Һ��pH��5.5��6.0֮�䣬����Ч�ʽϸߣ�������һ��������β��ʱ����ͨ�����ڰ�ˮ��������������������Һ��pH��

 �¿α�����Ķ�ѵ��ϵ�д�
�¿α�����Ķ�ѵ��ϵ�д�����Ŀ���о���������ʴ�����з�������ȷ����
��� | �� | �� | �� |
ʵ�� |
|
|
|
���� | 8Сʱδ�۲� ��������ʴ | 8Сʱδ�۲� ��������ʴ | 1Сʱ�۲� ��������ʴ |
A. ���У�NaCl��Һ���ܽ��O2������ʹ����Ƭ������ʴ
B. ���У�����Ƭδ������ʴ��ԭ��֮һ��ȱ��H2O
C. ����������Ӧ��O2+4e+ 2H2O ==4OH
D. �ԱȢ٢ڢۣ�˵�����ܸ���O2