��Ŀ����
����Ŀ����ҵȼ��ú��ʯ�͵Ȼ�ʯȼ���ͷų�������������(NOx)��CO2��CO��SO2�����壬������Ⱦ�������Է���������������̼����������ʵ����ɫ�������������á�
����������֪��H2��ȼ����Ϊ285.8 kJ/mol
N2(g) + 2O2(g)= 2NO2(g) ��H= +133 kJ/mol
H2O(g) =H2O(l) ������ ��H=- 44 kJ/mol
���������£�H2��ԭNO2����ˮ���������������ʵ��Ȼ�ѧ����ʽΪ_____________��
����̼��
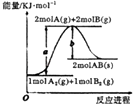
��1����2L�����ܱ������м���2 mol CO2��6 mol H2�����ʵ��Ĵ��������£�������Ӧ CO2(g) + 3H2(g) ![]() CH3OH(l) + H2O(l)������������˵���˷�Ӧ�ﵽƽ��״̬����__________________��
CH3OH(l) + H2O(l)������������˵���˷�Ӧ�ﵽƽ��״̬����__________________��
A����������ƽ��ʽ�����ֲ��� B��CO2��H2������������ֲ���
C��CO2��H2��ת������� D�����������ܶȱ��ֲ���
E��1 mol CO2���ɵ�ͬʱ��3 mol H��H������
��2����T1��ʱ�����Ϊ2L�ĺ��������г������ʵ���֮��Ϊ3mol��H2��CO��������ӦCO(g) + 2H2(g) ![]() CH3OH(g)��Ӧ�ﵽƽ��ʱCH3OH�����������V%����
CH3OH(g)��Ӧ�ﵽƽ��ʱCH3OH�����������V%����![]() �Ĺ�ϵ��ͼ��ʾ��
�Ĺ�ϵ��ͼ��ʾ��
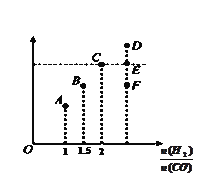
�ٵ���ʼ![]() =2������5min�ﵽƽ�⣬CO��ת����Ϊ0.4����0��5min��ƽ����Ӧ����V(H2)=___________������ʱ���������м���CO��g����CH3OH��g����0.4mol������ƽ��ʱH2��ת���ʽ�__________��ѡ���������С�����䡱����
=2������5min�ﵽƽ�⣬CO��ת����Ϊ0.4����0��5min��ƽ����Ӧ����V(H2)=___________������ʱ���������м���CO��g����CH3OH��g����0.4mol������ƽ��ʱH2��ת���ʽ�__________��ѡ���������С�����䡱����
�ڵ���ʼ![]() =3��5ʱ���ﵽƽ��״̬��CH3OH���������������ͼ���е�___________�㣨ѡ�D������E����F����
=3��5ʱ���ﵽƽ��״̬��CH3OH���������������ͼ���е�___________�㣨ѡ�D������E����F����
������
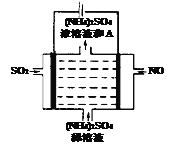
��ͼ���װ�ÿɽ������е�NO��SO2�ֱ�ת��ΪNH4+��SO42��������A�Ļ�ѧʽΪ_____________�������ĵ缫��Ӧʽ��________________________��
���𰸡� 4H2(g)+2NO2(g)��N2(g)+4H2O(g)��H= -1100.2kJ/mol DE 0.08mol/��L��min�� ��С F H2SO4 NO+6H++5e��=NH4++H2O
����������.��֪:������ȼ����Ϊ![]() ,��
,��![]() ����
����![]()
![]() ��
��![]()
![]() ��������
��������![]() ��-��
��-��![]() �õ�������������
�õ�������������![]() ��ԭ
��ԭ![]() ����ˮ�����͵������Ȼ�ѧ����ʽΪ4H2(g)+2NO2(g)��N2(g)+4H2O(g)��H= -1100.2kJ/mol ����ȷ��: 4H2(g)+2NO2(g)��N2(g)+4H2O(g)��H=-1100.2kJ/mol��
����ˮ�����͵������Ȼ�ѧ����ʽΪ4H2(g)+2NO2(g)��N2(g)+4H2O(g)��H= -1100.2kJ/mol ����ȷ��: 4H2(g)+2NO2(g)��N2(g)+4H2O(g)��H=-1100.2kJ/mol��
��1���÷�Ӧֻ�з�Ӧ��Ϊ���壬������ȫ��ΪҺ�壬�����������������������������ȱ仯����������ƽ��ʽ�����ֲ���ʱ�������жϴ˷�Ӧ�ﵽƽ��״̬��A������2L�ܱ������м���2 mol CO2��6 mol H2������![]() ��Ӧ�����Թ�����
��Ӧ�����Թ�����![]() ��
��![]() ���������ʼ�ձ��ֲ����������жϴ˷�Ӧ�ﵽƽ��״̬��B������2L�ܱ������м���2 mol CO2��6 mol H2������
���������ʼ�ձ��ֲ����������жϴ˷�Ӧ�ﵽƽ��״̬��B������2L�ܱ������м���2 mol CO2��6 mol H2������![]() ��Ӧ��
��Ӧ��![]() ��
��![]() ��ת����ʼ�����������ȷ����Ӧ�Ƿ�ﵽƽ��״̬��C��������Ӧ������������������Һ������Ӧ���ҽ��У�������������С������������䣬�����������ܶȱ��ֲ�����˵����Ӧ�ﵽƽ��״̬��D��ȷ��
��ת����ʼ�����������ȷ����Ӧ�Ƿ�ﵽƽ��״̬��C��������Ӧ������������������Һ������Ӧ���ҽ��У�������������С������������䣬�����������ܶȱ��ֲ�����˵����Ӧ�ﵽƽ��״̬��D��ȷ��![]()
![]() ���ɵ�ͬʱ��
���ɵ�ͬʱ��![]()
![]() ��������˵�����淴Ӧ������ͬ����Ӧ�ﵽƽ��״̬��E��ȷ����ȷѡ�DE��
��������˵�����淴Ӧ������ͬ����Ӧ�ﵽƽ��״̬��E��ȷ����ȷѡ�DE��
��2�������������֪��,��T1��ʱ�����Ϊ2L�ĺ��������г����H2��CO�����ʵ����ֱ���2 mol ��1 mol ,��H2��CO�ij�ʼŨ�ȷֱ�Ϊ1mol/L��0.5mol/L,����![]() �ﵽƽ��,CO��ת����Ϊ0.4,����һ����̼�仯Ũ��Ϊ0.2 mol/L ,��ΪŨ�ȵĸñ���֮�ȵ��ڼ�����֮�����ɼ��������Ũ�ȵı仯��0.4mol/L���״�Ũ�ȵı仯��Ϊ0.2mol/L����������ʽ����:
�ﵽƽ��,CO��ת����Ϊ0.4,����һ����̼�仯Ũ��Ϊ0.2 mol/L ,��ΪŨ�ȵĸñ���֮�ȵ��ڼ�����֮�����ɼ��������Ũ�ȵı仯��0.4mol/L���״�Ũ�ȵı仯��Ϊ0.2mol/L����������ʽ����:
CO(g)+ 2H2(g) ![]() CH3OH(g)
CH3OH(g)
��ʼŨ�� 0.5 1 0
�仯Ũ�� 0.2 0.4 0.2
ƽ��Ũ�� 0.3 0.6 0.2
��0��5min��ƽ����Ӧ����V(H2)=0.4/5=0.08mol/��L��min���� ���¶��¸÷�Ӧ��ƽ�ⳣ��Ϊ��0.2/0.3��(0.6)2=50/27������ʱ���������м���CO��g����CH3OH��g����0.4mol��������Ũ��Ϊ��c(CO)=0.3+0.4/2=0.5 mol/L, c(H2)= 0.6 mol/L, c(CH3OH)= 0.2+0.4/2=0.4 mol/L,��Ũ����QC=0.4/0.5��(0.6)2>50/27��ƽ�����ƣ�H2��ת���ʽ���С����ȷ����0.08mol/��L��min������С��
����ϱ������ڻ�ѧ������֮��ʱ,ƽ��ʱ������ĺ���������ʵ���ʼ![]() =3��5ʱ��,�ﵽƽ��״̬��, CH3OH���������С��C������ѡF����ȷѡ��F��
=3��5ʱ��,�ﵽƽ��״̬��, CH3OH���������С��C������ѡF����ȷѡ��F��
������NO��SO2�ֱ�ת��ΪNH4+��SO42����֪��NO����ԭ��SO2�����������ص�����������ԭ��Ӧ��NO�õ��ӱ�ΪNH4+������ӦΪ��NO+6H++5e��=NH4++H2O����������ӦΪ��SO2-2 e��+2H2O= SO42��+4H+,����������Ӧ��֪���÷�Ӧ���ղ������ᣬ����A�Ļ�ѧʽΪH2SO4����ȷ�𰸣�H2SO4��NO+6H++5e��=NH4++H2O��