题目内容
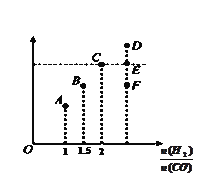
【题目】在密闭容器中,给一氧化碳和水蒸气的气体混合物加热,在催化剂存在下发生反应:CO(g)+H2O(g)H2(g)+CO2(g).在500℃时,平衡常数K=9.若反应开始时,一氧化碳和水蒸气的浓度都是0.02mol/L,则在此条件下CO的转化率为( )
A.25%
B.50%
C.75%
D.80%
【答案】C
【解析】解:依据化学平衡,设一氧化碳的消耗浓度为X,分析三段式列式计算:
CO(g)+ | H2O(g) | H2(g)+ | CO2(g) | |
起始(mol/L) | 0.02 | 0.02 | 0 | 0 |
转化(mol/L) | x | x | x | x |
平衡(mol/L) | 0.02-x | 0.02-x | x | x |
平衡常数K= ![]() =
= ![]() =9
=9
解得:X=0.015mol/L;
一氧化碳转化率= ![]() ×100%=75%
×100%=75%
故选C.
依据化学平衡的三段式列式计算,平衡状态下的物质浓度,运用平衡常数的概念列式得到;

【题目】某学生为了探究影响化学反应速率的外界因素,进行以下实验。
(1)向100mL稀硫酸中加入过量的锌粉,标准状况下测得数据累计值如下:
时间/min | 1 | 2 | 3 | 4 | 5 |
氢气体积/mL | 50 | 120 | 232 | 290 | 310 |
①在0~1、1~2、2~3、3~4、4~5min各时间段中:
反应速率最大的时间段是________min,主要的原因可能是_____________________;
反应速率最小的时间段是________min,主要的原因可能是_____________________。
②为了减缓反应速率但不减少产生氢气的量,可以在稀硫酸中加入________(填序号)。
a.蒸馏水 b.NaOH溶液 c.NaNO3溶液 d.Na2CO3溶液
(2)进行以下对比实验并记录实验现象。
实验 Ⅰ
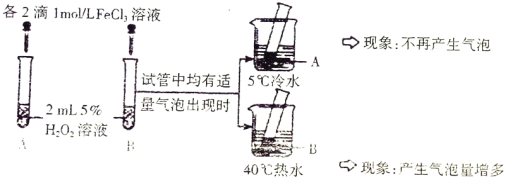
实验 Ⅱ:另取两支试管分别加入5mL5%eH2O2溶液和5mL10%H2O2溶液,均未观察到有明显的气泡
产生。
①双氧水分解的化学方程式是________________。
②实验 Ⅰ 的目的是______________。
③实验 Ⅱ 未观察到预期现象,为了达到该实验的目的,可采取的改进措施是__________________。