题目内容
6. 如图是某兴趣小组探究不同条件下化学能转变为电能的装置
如图是某兴趣小组探究不同条件下化学能转变为电能的装置(1)当电极a为Fe、电极b为Cu、电解质溶液为硫酸铜溶液时,正极的电极反应式为Cu2++2e-=Cu
(2)当电极a吸附CH4、电极b吸附O2,电解质溶液为氢氧化钠溶液时,该装置能 (填“能”或“不能”)形成原电池,若不能,请说明理由,若能,请写出负极电极反应式CH4-8e-+10OH-=CO32-+7H2O.
分析 (1)Fe、Cu、硫酸铜溶液构成的原电池,金属Fe作负极,金属Cu为正极,正极上铜离子得到电子,负极上Fe失去电子;
(2)当电极a吸附CH4、电极b吸附O2,电解质溶液为氢氧化钠溶液时形成燃料电池,燃料电池中,负极上燃料失电子发生氧化反应,正极上氧化剂得电子发生还原反应,电子从负极沿导线流向正极.
解答 解:(1)Fe、Cu、硫酸铜溶液构成的原电池,金属Fe作负极,金属Cu为正极,正极上铜离子得到电子,电极反应式为Cu2++2e-=Cu,故答案为:Cu2++2e-=Cu;
(2)当电极a吸附CH4、电极b吸附O2,电解质溶液为氢氧化钠溶液时形成燃料电池,燃料电池中,负极上燃料失电子发生氧化反应,电极反应式为CH4-8e-+10OH-=CO32-+7H2O,故答案为:能;CH4-8e-+10OH-=CO32-+7H2O.
点评 本题考查了原电池的反应原理以及燃料电池的工作原理,题目难度不大,注意电极反应式的书写.

练习册系列答案
相关题目
17.有关下列实验操作和相应的离子方程式的说法正确的是( )
| A. | 等物质的量MgCl2、Ba(OH)2和HCl溶液混合:Mg2++3OH-+H+=Mg(OH)2↓+H2O | |
| B. | Ca(HCO3)2溶液与过量NaOH溶液反应:Ca2++HCO3-+OH-=CaCO3↓+2H2O | |
| C. | 等物质的量的FeBr2与Cl2反应为:2Fe2++2Br-+2Cl2=2Fe3++Br2+4Cl- | |
| D. | 用浓盐酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
14.下列化合物中含有共价键的离子化合物是( )
| A. | Na2S | B. | CaCl2 | C. | Na2O2 | D. | H2O2 |
1.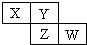 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
 X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )
X、Y、Z均为短周期元素,它们在周期表中相对位置如图所示.若Y原子的最外层电子是内层电子数的3倍,下列说法正确的是( )| A. | X的非金属性比Y的强 | |
| B. | Y的原子半径比Z的原子半径大 | |
| C. | Z的最高价氧化物的水化物为强酸 | |
| D. | W的单质可与Y的氢化物生成两种强酸 |
11.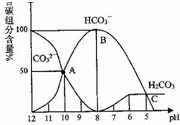 常温下,某Na2CO3溶液中含有碳组分含量(物质的量分数)随溶液的pH逐渐降低而发生变化如图,下列说法正确的是( )
常温下,某Na2CO3溶液中含有碳组分含量(物质的量分数)随溶液的pH逐渐降低而发生变化如图,下列说法正确的是( )
 常温下,某Na2CO3溶液中含有碳组分含量(物质的量分数)随溶液的pH逐渐降低而发生变化如图,下列说法正确的是( )
常温下,某Na2CO3溶液中含有碳组分含量(物质的量分数)随溶液的pH逐渐降低而发生变化如图,下列说法正确的是( )| A. | 在滴有酚酞的Na2CO3溶液中逐滴加盐酸至溶液恰好变为无色,得到溶液 | |
| B. | 有CO2气体放出的范围是pH≤5 | |
| C. | HCO3-的电离平衡常数为1×10-4 | |
| D. | pH=11的Na2CO3溶液稀释到体积为原来的100倍后pH=9 |
18.下列关于硫酸性质的描述中,正确的是( )
| A. | 浓H2SO4有氧化性,稀H2SO4无氧化性 | |
| B. | 由于浓H2SO4具有脱水性,所以可用做干燥剂 | |
| C. | 稀H2SO4与铜不反应,但浓H2SO4在加热条件下可与铜反应 | |
| D. | 在受热的情况下浓硫酸也不与铁、铝发生反应 |
16.下列有关化学用语或名称,表达正确的是( )
| A. | 聚丙烯的结构简式为: | B. | 苯分子的比例模型: | ||
| C. | 四氯化碳分子的电子式为: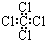 | D. | 乙烯的结构简式:CH2CH2 |


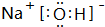 ; 用电子式表示G与Q形成化合物的过程
; 用电子式表示G与Q形成化合物的过程 ;
; .
.