��Ŀ����
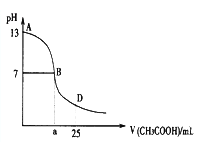
����Ŀ����ӦFe��H2SO4===FeSO4��H2���������仯��������ͼ��ʾ��
(1)�÷�ӦΪ________��Ӧ(����ȡ����ȡ�)��
(2)��Ҫʹ�÷�Ӧ�ķ�Ӧ���ʼӿ죬���д�ʩ���е���__________(����ĸ)��
A������ƬΪ���� B����ϡ����Ϊ98%��Ũ���� C�������¶�
(3)����������Ӧ��Ƴ�ԭ��أ�ͭΪԭ���ijһ�����ϣ���ͭΪ________��(���������)��ͭ�缫�ϲ���������Ϊ____________���ü��Ϸ����ĵ缫��ӦΪ____________________�����·�е�����____________��(�������������ͬ)��________���ƶ���
���𰸡� ���� AC �� ������ɫ���� 2H����2e��===H2�� �� ��
�����������������(1)����ͼ���֪��Ӧ���������������������������(2)����Ӱ�췴Ӧ���ʵ����ط���ʹ�÷�Ӧ�ķ�Ӧ���ʼӿ�ķ�����(3)����ԭ��ظ�������������Ӧ������������ԭ��Ӧ�ж��������������ܷ�Ӧд�������ĵ缫��Ӧ�������и�������������
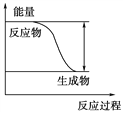
������(1) ��Ӧ������������������������������Ը÷�ӦΪ���ȷ�Ӧ��
(2)A������ƬΪ���ۣ�����Ӵ��������Ӧ���ʼӿ죬��A��ȷ����ϡ����Ϊ98%��Ũ���ᣬ�������ۻ�����B���������¶ȣ�����һ������C��ȷ��
(3)�����ܷ�Ӧ����ʽ��������������Ӧ����Ϊ��������ͭΪ������������ӦΪ![]() ��������ӦΪ
��������ӦΪ![]() �� ����ͭ�缫�ϲ���������Ϊ������ɫ���ݣ����·�е����ɸ��������ƶ���
�� ����ͭ�缫�ϲ���������Ϊ������ɫ���ݣ����·�е����ɸ��������ƶ���

 ��1����Ԫ�¿�������ĩϵ�д�
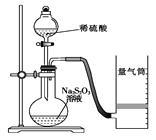
��1����Ԫ�¿�������ĩϵ�д�����Ŀ����1����ѧ��Ӧ������������ѧ��Ӧ���п����̶ȵ�����������ͼ��ijͬѧ����ϡ�������������ƣ�Na2S2O3���ķ�Ӧ���ⶨ��ѧ��Ӧ���ʲ�̽����Ӱ�����ص�ʵ�顣
��.�ⶨ��ѧ��Ӧ���ʣ���֪��S2O![]() ��2H�� === H2O��S����SO2��
��2H�� === H2O��S����SO2��
�� ����ͼװ����ʾ��ʵ����Ʒ�⣬����Ҫ��һ��ʵ����Ʒ��__________��
�� ����2 minʱ�ռ���224 mL(��״����)���壬�ɼ������2 min��H���ķ�Ӧ���ʣ����òⶨֵ��ʵ��ֵƫС����ԭ����_____________________��
�� ���øû�ѧ��Ӧ���Լ���һ�ֲⶨ��Ӧ���ʵ�����������_______________��
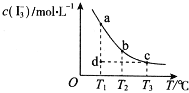
��.̽����ѧ��Ӧ���ʵ�Ӱ�����أ���֪ I2��2S2O32- === S4O62- ��2I��
Ϊ̽�ַ�Ӧ��Ũ�ȶԻ�ѧ��Ӧ���ʵ�Ӱ�죬��Ƶ�ʵ�鷽�����±���
(��֪Na2S2O3��Һ����)
ʵ����� | ���V/mL | ʱ��/s | |||
Na2S2O3��Һ | ������Һ | ��ˮ | ˮ | ||
�� | 10.0 | 2.0 | 4.0 | 0.0 | t1 |
�� | 8.0 | 2.0 | 4.0 | 2.0 | t2 |
�� | 6.0 | 2.0 | 4.0 | V | t3 |
�� ����V ��__________mL��t1��t2��t3�Ĵ�С��ϵ��____________________________��
( 2 ) ���������£�������̶����ܱ������У�������ӦX��g��+3Y��g��![]() 2Z��g������X��Y��Z��ʼŨ�ȷֱ�Ϊc1��c2��c3������Ϊ0����ƽ��ʱX��Y��Z��Ũ�ȷֱ�Ϊ0.1molL��1��0.3molL��1��0.08molL��1��
2Z��g������X��Y��Z��ʼŨ�ȷֱ�Ϊc1��c2��c3������Ϊ0����ƽ��ʱX��Y��Z��Ũ�ȷֱ�Ϊ0.1molL��1��0.3molL��1��0.08molL��1��
��ش��������⣺
�� c1+c2+c3��ȡֵ��ΧΪ____________________
�� c1��c2��ֵΪ__________________ ������������֤���÷�Ӧ�Ѵﵽ��ѧƽ��״̬���� __________ A.��������ܶȲ��ٱ仯 B.v����X��=2 v����Z�� C.������ѹǿ���ٷ����仯 D.��������ƽ����Է������� E. X�����ʵ�����Y�����ʵ���֮��