题目内容
【题目】根据下图海水综合利用的工业流程图,判断下列说法正确的是( )
已知:MgCl2·6H2O受热生成Mg(OH)Cl和HCl气体等。
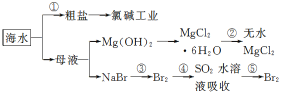
A.除去粗盐中杂质(Mg2+、SO42-、Ca2+),加入的药品顺序为:NaOH溶液→Na2CO3溶液→BaCl2溶液→过滤后加盐酸
B.在过程②中将MgCl2·6H2O灼烧即可制得无水MgCl2
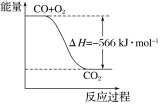
C.从能量转换角度来看,氯碱工业中的电解饱和食盐水是一个将化学能转化为电能的过程
D.从第③步到第⑤步的目的是为了制取并提纯Br2
【答案】D
【解析】
试题分析:A、过程①加入的药品顺序为BaCl2溶液→NaOH溶液→Na2CO3溶液→过滤后加盐酸,如果在过滤沉淀前加入过量BaCl2溶液,稀盐酸不能除去氯化钡溶液,所以会产生杂质,A错误;B、在过程②中将MgCl26H2O灼烧促进氯化镁水解,最终得到氧化镁,B错误;C、根据电解原理分析,电解饱和食盐水是电能转化为化学能,C错误;D、溴离子被氧化为溴单质后,被二氧化硫吸收生成溴离子,加入氧化剂氧化溴离子为溴单质,富集溴元素,从第③步到第⑤步的目的是为了浓缩,D正确;答案选D。

练习册系列答案
 口算能手系列答案
口算能手系列答案
相关题目