题目内容
14.NA为阿伏加德罗常数,下列说法正确的是( )| A. | 标准状况下,11.2 L的丙烷所含的氢原子数为4NA | |
| B. | 16g甲烷所含电子数目为16NA | |
| C. | 标准状况下,11.2 L三氯甲烷所含分子数为0.5NA | |
| D. | 14 g乙烯的原子数为3NA |
分析 A、标准状况下,11.2 L的丙烷的物质的量为0.5mol,而1mol丙烷含8mol氢原子;
B、求出甲烷的物质的量,然后根据甲烷是10电子分子;
C、标况下,三氯甲烷为液态;
D、求出乙烯的物质的量,然后根据1mol乙烯中含6mol原子来计算.
解答 解:A、标准状况下,11.2 L的丙烷的物质的量为0.5mol,而1mol丙烷含8mol氢原子,故0.5mol丙烷含4mol氢原子,故A正确;
B、16g甲烷的物质的量为1mol,而甲烷是10电子分子,故1mol甲烷含10mol电子,故B错误;
C、标况下,三氯甲烷为液态,故不能根据气体摩尔体积来计算,故C错误;
D、14g乙烯的物质的量n$\frac{14g}{28g/mol}$=0.5mol,而1mol乙烯中含6mol原子,故0.5mol乙烯中含3mol原子,故D正确.
故选AD.
点评 本题考查了阿伏伽德罗常数的有关计算,熟练掌握公式的使用和物质的结构是解题关键,难度不大.

练习册系列答案
 课课优能力培优100分系列答案
课课优能力培优100分系列答案 优百分课时互动系列答案
优百分课时互动系列答案
相关题目
2.提纯下列物质所选试剂及对应分离方法均可行的是( )
| 物质 | 杂质 | 所选试剂 | 方法 | |
| A | 乙烷 | 乙烯 | 酸性KMnO4溶液 | 洗气 |
| B | 溴苯 | 溴 | H2O | 萃取 |
| C | 乙炔 | 硫化氢 | 硫酸铜溶液 | 洗气 |
| D | 乙酸乙酯 | 乙酸 | 饱和Na2CO3溶液 | 分液 |
| A. | A | B. | B | C. | C | D. | D |
9.下列关于元素周期表的叙述正确的是( )
| A. | 同周期元素的电子层数相等 | |
| B. | 同族元素的最外层电子数一定相等 | |
| C. | 周期表是按各元素的相对原子质量递增的顺序从左到右排列的 | |
| D. | 每一周期的元素都是从碱金属开始,以稀有气体结束 |
19.均不属于大气污染物的一组气体是( )
| A. | N2和O2 | B. | CO和CO2 | C. | NO和NO2 | D. | SO2和碳氢化合物 |
6.下列说法正确的是( )
| A. | 钠的金属性比钾强 | |
| B. | 溴的非金属性比氯强 | |
| C. | IIA族中原子半径最小的是铍 | |
| D. | 第二周期中,除稀有气体元素外原子半径最大的是锂 |
 如图所示,
如图所示,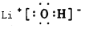 .
.
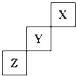 短周期元素X、Y、Z在周期表中位置关系如图所示,
短周期元素X、Y、Z在周期表中位置关系如图所示, .写出Z单质与铁反应的化学反应方程式:Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS.
.写出Z单质与铁反应的化学反应方程式:Fe+S$\frac{\underline{\;\;△\;\;}}{\;}$FeS. 在一定条件下,N2(g)+H2(g)?2NH3(g),该反应的能量变化为放出92.4KJ热量,在容积为2升的密闭容器中,分别充入1molN2和1molH2,2min反应达到最大限度,三种气态物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白:
在一定条件下,N2(g)+H2(g)?2NH3(g),该反应的能量变化为放出92.4KJ热量,在容积为2升的密闭容器中,分别充入1molN2和1molH2,2min反应达到最大限度,三种气态物质的量随时间的变化曲线如图所示.根据图中数据,试填写下列空白: