题目内容
下列离子方程式正确的是 ( )
| A.NH4HCO3溶液与过量NaOH溶液反应:NH 4++ OH―=NH3↑+ H2O |
B.用惰性电极电解饱和氯化钠溶液:2Cl― + 2H +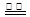 H2↑+ Cl2↑ H2↑+ Cl2↑ |
| C.向Fe(NO3)3溶液中加入过量的HI溶液:2Fe3++2I―= 2Fe2++I2 |
| D.Na2SO3溶液使酸性KMnO4溶液褪色:5SO32― + 6H+ + 2MnO4―=5SO42― + 2Mn2+ +3H2O |
D
解析试题分析:A.NH4HCO3溶液与过量NaOH溶液反应:NH 4++ HCO3-+ 2OH―=NH3·H2O +H2O+ CO32-
错误。B.用惰性电极电解饱和氯化钠溶液:2Cl― + 2H2O H2↑+ Cl2↑+2OH-。错误。C.向Fe(NO3)溶液中加入过量的HI溶液:8H++2NO3-+6I―=2NO↑+3I2+4H2O.错误。D.符合客观事实。符合电子守恒和原子守恒和电荷守恒。正确。
H2↑+ Cl2↑+2OH-。错误。C.向Fe(NO3)溶液中加入过量的HI溶液:8H++2NO3-+6I―=2NO↑+3I2+4H2O.错误。D.符合客观事实。符合电子守恒和原子守恒和电荷守恒。正确。
考点:考查离子方程式正确书写的知识。

练习册系列答案
相关题目
下列实验设计及其对应的离子方程式均正确的是( )
| A.用FeCl3溶液腐蚀铜线路板:Cu+2Fe3+=Cu2++2Fe2+ |
| B.Na2O2与H2O反应制备O2:Na2O2+H2O=2Na++2OH-+O2↑ |
| C.将氯气溶于水制备次氯酸:Cl2+H2O=2H++Cl-+ClO- |
| D.用稀硫酸酸化的KMnO4溶液与H2O2反应,证明H2O2具有还原性:2MnO4-+6H++5H2O2=2Mn2++5O2↑+8H2O |
下列离子方程式中正确的是( )
| A.将金属钠加入水中 Na + 2H2O= Na+ + 2OH- + H2 ↑ |
B.氯气通入水中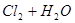   |
| C.FeBr2溶液中加入过量的新制氯水 2Fe2++4Br-+3Cl2 =2Br2+6Cl-+2Fe3+ |
| D.氯化铝溶液中加入过量氨水 A13++4NH3·H2O |
下列评价合理的是( )
| 选项 | 化学反应及其离子方程式 | 评价 |
| A | Fe3O4与稀硝酸反应:2 Fe3O4+18H+=6Fe3++H2↑+8H2O | 正确 |
| B | 向碳酸镁中加入稀盐酸: CO32—+2H+=CO2↑+H2O | 错误,碳酸镁不应写成离子形式 |
| C | 向硫酸铵溶液中加入氢氧化钡溶液:Ba2++SO42—=BaSO4↓ | 正确 |
| D | FeBr2溶液与等物质的量的Cl2反应:2Fe2++2Br—+2Cl2="2" Fe3++4Cl—+Br2 | 错误:Fe2+与Br—的化学计量数之比应为1:2 |
下列各组离子在给定条件下,能大量共存的是( )
| A.含有NO3–的水溶液中:NH4+、Fe2+、SO 42– 、H+ |
| B.含有CO32–的澄清透明溶液中:K+、C6H5O–、Cl–、Na+ |
| C.在pH=2的溶液中:ClO–、SO32–、Na+ 、K+ |
| D.能与铝粉反应生成氢气的溶液中:Na+、Al3+、CH3COO–、I– |
下列离子方程式正确的是
| A.等物质的量的Ba(OH)2与KAl(SO4)2·12H2O溶液混合: 3Ba2++6OH-+2Al3++3SO42-=3BaSO4↓+2Al(OH)3↓ |
| B.Fe(OH)3溶于氢碘酸:Fe(OH)3+3H+=Fe3++3H2O |
| C.H218O中投入Na2O2固体:2H218O+2O22-=4OH-+18O2↑ |
| D.CuCl2溶液中加入NaHS溶液:Cu2++2HS-+2H2O=Cu(OH)2↓+2H2S↑ |
下列设计与离子反应方程式书写均正确的是( )
A.磁性氧化铁溶于氢碘酸:Fe3O4+8H+ 2Fe3++Fe2++4H2O 2Fe3++Fe2++4H2O |
B.用过量氨水吸收工业尾气中的SO2:2NH3·H2O+SO2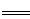 2NH4++SO32-+H2O 2NH4++SO32-+H2O |
C.用浓盐酸酸化的高锰酸钾溶液与过氧化氢反应:2MnO4- +5H2O2 + 6H+ 2Mn2+ +5O2↑ + 8H2O 2Mn2+ +5O2↑ + 8H2O |
D.用氨水洗涤试管内壁的银镜:Ag++2NH3·H2O [Ag(NH3)2]++2H2O [Ag(NH3)2]++2H2O |
有一无色混合物的水溶液,只可能含有以下离子中的若干种:K+、NH4+、Cl-、Mg2+、Fe3+、CO32-、SO42-、H+,现取三份100mL溶液进行如下实验:
(1)第一份加入足量AgNO3溶液有沉淀产生
(2)第二份加足量NaOH溶液加热后,收集到气体0.04mol
(3)第三份加足量BaCl2溶液后,得干燥沉淀6.27g,经足量盐酸洗涤、干燥后,沉淀质量为2.33g。
根据上述实验,以下推测正确的是( )
| A.Fe3+一定不存在,Mg2+可能存在 |
| B.100mL溶液中含0.01mol CO32- |
| C.Cl-一定存在 |
| D.K+一定存在 |