题目内容
下列关于电解质溶液的叙述正确的是
| A.中和pH与体积都相同的盐酸和硫酸,消耗NaOH的物质的量之比是1∶2 |
| B.pH=13的氨水加水稀释后,溶液中所有离子的浓度均降低 |
| C.浓度均为0.1 mol·L-1的下列溶液,pH由大到小排列顺序为:NaOH>Na2CO3>NaHSO4>(NH4)2SO4 |
| D.0.1 mol·L-1的硫酸铵溶液中,离子浓度大小顺序为: c(NH4+)>c(SO42-)>c(H+) >c(OH-) |
D
试题分析:A由于中和的盐酸和硫酸pH与体积都相同,所以溶液中的氢离子都相同,则消耗NaOH的物质的量之比是1∶1,故错
B、pH=13的氨水中含有H+ NH4+ OH-,由于溶液体积增大OH-浓度减小,但是溶液中由于H+和OH-乘积是定值,所以氢离子浓度增大
C.浓度均为0.1 mol·L-1的下列溶液,由于碳酸钠呈碱性,硫酸氢钠能电离出氢离子浓度大于铵根离子水解产生的氢离子浓度,所以硫酸氢钠的酸性最强,pH最小,pH由大到小排列顺序为:NaOH>Na2CO3>(NH4)2SO4> NaHSO4,
D.0.1 mol·L-1的硫酸铵(NH4)2SO4溶液中,溶液呈酸性,离子浓度大小顺序为: c(NH4+)>c(SO42-)>c(H+) >c(OH-),故对。
点评:本题主要考察了离子浓度大小的比较,掌握离子能否发生水解是解题的关键,

练习册系列答案
相关题目
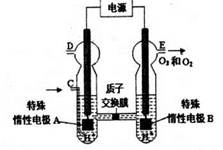
 2O3
2O3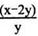 (忽略O3的分解)
(忽略O3的分解)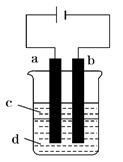

 ”。
”。
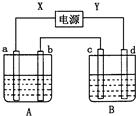
 2OH-+H2↑+Cl2↑
2OH-+H2↑+Cl2↑