题目内容
【题目】天然气是一种重要的清洁能源和化工原料,其主要成分为甲烷。
(1)工业上可用煤制天然气,生产过程中有多种途径生成![]()
①写出![]() 与
与![]() 反应生成
反应生成![]() 和
和![]() 的热化学方程式 ______。
的热化学方程式 ______。
已知:![]() ,
,
![]() ,
,
![]()
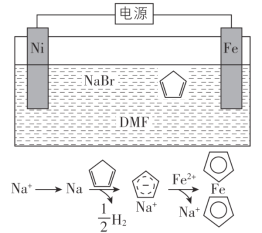
②科学家用氮化镓材料与铜组装如图的人工光合系统,利用该装置成功地实现了以![]() 和
和![]() 合成
合成![]()
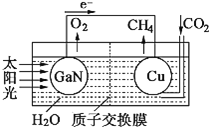
写出铜电极表面的电极反应式 ______ 。为提高该人工光合系统的工作效率,可向装置中加入少量 ______ ![]() 选填“盐酸”或“硫酸”
选填“盐酸”或“硫酸”![]() 。
。
③另一生成![]() 的途径是
的途径是![]() ,某温度下,将
,某温度下,将![]() 和
和![]() 充入10L的密闭容器内发生反应
充入10L的密闭容器内发生反应![]() ,平衡时
,平衡时![]() 的转化率为
的转化率为![]() ,求此温度下该反应的平衡常数
,求此温度下该反应的平衡常数![]() ______
______ ![]() 计算结果保留两位有效数字
计算结果保留两位有效数字![]() 。
。
(2)天然气中的![]() 杂质常用氨水吸收,产物为
杂质常用氨水吸收,产物为![]() ,一定条件下向
,一定条件下向![]() 溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 ______。
溶液中通入空气,得到单质硫并使吸收液再生,写出再生反应的化学方程式 ______。
(3)天然气的一个重要用途是制取![]() ,其原理为:
,其原理为:![]() 。在密闭容器中通入物质的量浓度均为
。在密闭容器中通入物质的量浓度均为![]() 的
的![]() 与
与![]() ,在一定条件下发生反应,测得
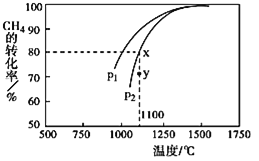
,在一定条件下发生反应,测得![]() 的平衡转化率与温度及压强的关系如图所示,则压强
的平衡转化率与温度及压强的关系如图所示,则压强![]() ______
______ ![]() (填“大于”或“小于”
(填“大于”或“小于”![]() ;压强为
;压强为![]() 时,在y点:v(正) ______ v(逆)(填“大于”、“小于”或“等于”)。
时,在y点:v(正) ______ v(逆)(填“大于”、“小于”或“等于”)。
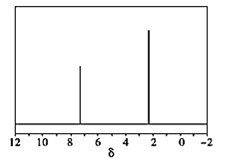
(4)天然气也可重整生产化工原料,最近科学家们利用天然气无氧催化重整获得芳香烃![]() 由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图,则X的结构简式为 ______。
由质谱分析得X的相对分子质量为106,其核磁共振氢谱如图,则X的结构简式为 ______。
【答案】![]()
![]() 硫酸
硫酸 ![]()
![]() 小于 大于
小于 大于 
【解析】
(1)①根据盖斯定律书写目标热化学方程式;
②由电池装置图可知,Cu上二氧化碳得电子生成甲烷;根据酸的挥发性分析;
③计算平衡时氢气浓度变化量,利用三段式计算平衡时各组分浓度,代入平衡常数表达式计算;
(2)![]() 中硫元素为
中硫元素为![]() 价,具有还原性能被氧气氧化为硫单质,同时可使吸收液再生,则生成氨水;
价,具有还原性能被氧气氧化为硫单质,同时可使吸收液再生,则生成氨水;
(3)该反应正向为气体体积增大的反应,压强越大,![]() 的转化率越小;压强为
的转化率越小;压强为![]() 时,在y点反应未达到平衡,反应正向进行;
时,在y点反应未达到平衡,反应正向进行;
(4)已知X的相对分子质量为106,设其分子式为![]() ,由
,由![]() 可知
可知![]() ,
,![]() ,再根据质谱图中有2个峰,判断分子中含有2种环境的H。
,再根据质谱图中有2个峰,判断分子中含有2种环境的H。
(1)①已知:①![]() ,
,
②![]() ,
,
③![]() ,
,
根据盖斯定律,②+③-①×2得:![]() ,故答案为:
,故答案为:![]() ;
;
②由电池装置图可知,Cu上二氧化碳得电子生成甲烷,则Cu电极上的电极反应为:![]() ;可向装置中加入少量的酸作电解质,由于盐酸易挥发,生成的甲烷中会混有HCl气体,所以选用硫酸,不用盐酸,故答案为:
;可向装置中加入少量的酸作电解质,由于盐酸易挥发,生成的甲烷中会混有HCl气体,所以选用硫酸,不用盐酸,故答案为:![]() ;硫酸;
;硫酸;
③平衡时![]() 的转化率为
的转化率为![]() ,参加反应氢气的物质的量
,参加反应氢气的物质的量![]() ,故氢气的浓度变化量
,故氢气的浓度变化量![]() ,则可列出三段式(单位为mol/L):
,则可列出三段式(单位为mol/L):

故平衡常数![]() ,故答案为:
,故答案为:![]() ;
;
(2)已知天然气中的![]() 杂质常用氨水吸收,产物为
杂质常用氨水吸收,产物为![]() ,一定条件下向
,一定条件下向![]() 溶液中通入空气,得到单质硫并使吸收液再生,由此可知,
溶液中通入空气,得到单质硫并使吸收液再生,由此可知,![]() 中硫元素为
中硫元素为![]() 价,具有还原性能被氧气氧化为硫单质,同时反应生成氨水,则反应方程式为:
价,具有还原性能被氧气氧化为硫单质,同时反应生成氨水,则反应方程式为:![]() ,故答案为:
,故答案为:![]() ;
;
(3)该反应正向为气体体积增大的反应,压强越大,![]() 的转化率越小,已知相同温度下,
的转化率越小,已知相同温度下,![]() 条件下的转化率大于
条件下的转化率大于![]() ,则
,则![]() 小于
小于![]() ;压强为
;压强为![]() 时,在y点反应未达到平衡,且此时甲烷的转化率小于平衡转化率,则应反应正向进行,所以v(正)大于v(逆),故答案为:小于;大于;
时,在y点反应未达到平衡,且此时甲烷的转化率小于平衡转化率,则应反应正向进行,所以v(正)大于v(逆),故答案为:小于;大于;
(4)芳香烃X,已知X的相对分子质量为106,设其分子式为![]() ,由
,由![]() 可知
可知![]() ,
,![]() ,该分子中含有一个苯环,另外还有2个C原子,再根据质谱图中有2个峰,可知分子中含有2种环境的H,则分子结构对称,所以其结构简式为
,该分子中含有一个苯环,另外还有2个C原子,再根据质谱图中有2个峰,可知分子中含有2种环境的H,则分子结构对称,所以其结构简式为![]() ,故答案为:
,故答案为:![]() 。
。