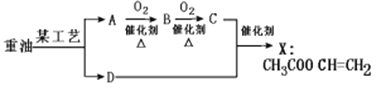
题目内容
【题目】在0.1L由NaCl、MgCl2、BaCl2组成的混合溶液中,部分离子浓度大小如图所示,下列对该溶液成分说法不正确的是( )
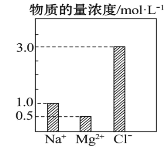
A.NaCl的物质的量为0.1mol
B.溶质MgCl2的质量为4.75g
C.该混合液中BaCl2的物质的量为0.1mol
D.将该混合液加水稀释至体积为1L,稀释后溶液中的Na+物质的量的浓度为0.1mol·L-1
【答案】C
【解析】
A、由图可知,c(Na+)=1.0mol/L,该混合液中,NaCl的物质的量为0.1L×1.0mol/L=0.1mol,故A正确;
B、c(Mg2+)=0.5mol/L,含溶质MgCl2的质量为0.1L×0.5mol/L×95g/mol=4.75g,故B正确;
C、根据电荷守恒可知,2c(Ba2+)+c(Na+)+2c(Mg2+)=c(Cl-),即2c(Ba2+)+1.0mol/L +2×0.5mol/L =3.0mol/L,解得:c(Ba2+)=0.5mol/L,BaCl2的物质的量为:0.5mol/L×0.1L=0.05mol,故C错误;
D、该混合液中,NaCl的物质的量为0.1mol,即钠离子的物质的量为0.1mol,将该混合液加水稀释至体积为1 L,稀释后溶液中的Na+物质的量浓度为![]() =0.1mol/L,故D正确;
=0.1mol/L,故D正确;
故选C。

【题目】t ℃时,在体积不变的密闭容器中发生反应:X(g)+3Y(g)![]() 2Z(g),各组分在不同时刻的浓度如下表,下列说法正确的是
2Z(g),各组分在不同时刻的浓度如下表,下列说法正确的是
物质 | X | Y | Z |
初始浓度/mol·L-1 | 0.1 | 0.2 | 0 |
2 min末浓度/mol·L-1 | 0.08 | a | b |
平衡浓度/mol·L-1 | 0.05 | 0.05 | 0.1 |
A. 平衡时,X的转化率为20%
B. t ℃时,该反应的平衡常数为40
C. 前2 min内,用Y的变化量表示的平均反应速率v(Y)="0.03" mol·L-1·min-1
D. 增大平衡后的体系压强,v正增大,v逆减小,平衡向正反应方向移动