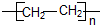题目内容
 如图中A、B、C、D是同周期或同主族的相邻元素:
如图中A、B、C、D是同周期或同主族的相邻元素:①已知:A元素的最低价为-3价,它的最高价氧化物含氧56.34%,原子核内中子数比质子数多1个,则A元素原子质量数为
31
31
,原子序数为15
15
,A元素位于第三
三
周期VA
VA
族.②写出元素符号A:
P
P
,B:S
S
,C:Cl
Cl
,D:O
O
.③A、B、C三种元素最高价氧化物的水化物的化学式依次为
H3PO4
H3PO4
,H2SO4
H2SO4
,HClO4
HClO4
,其中酸性最强的是HClO4
HClO4
.④B、D两种元素和氢组成的气态氢化物的化学式依次为
H2S
H2S
,H2O
H2O
其中H2O
H2O
稳定性最大,H2S
H2S
还原性最强.分析:A元素的最低价为-3价,则最高价为+5价,它的最高价氧化物为A2O5,含氧56.34%,设相对原子质量为x,则
×100%=56.34%,解得x=31,确定A为P,再由元素在周期表中的位置可知,B为S,C为Cl,D为O,利用元素的非金属性越强,最高价氧化物的水化物的越强,气态氢化物的稳定性越强来解答.
| x×2 |
| x×2+16×5 |
解答:解:(1)由A元素的最低价为-3价,则最高价为+5价,它的最高价氧化物为A2O5,含氧56.34%,设相对原子质量为x,
则
×100%=56.34%,解得x=31,
质子数等于原子序数,设原子序数为y,原子核内中子数比质子数多1个,中子数为y+1,
则y+(y+1)=31,解得y=15,即A为P元素,原子结构中有3个电子层,最外层有5个电子,
P位于元素周期表中的第三周期第ⅤA族,
故答案为:31;15;三;ⅤA;
(2)由元素在周期表中的位置可知,A、B、C同周期相邻元素,B、D为同主族元素,则B为S,C为Cl,D为O,
故答案为:P;S;Cl;O;
(3)A、B、C同周期,从左到右元素的非金属性在增强,三种元素最高价氧化物的水化物的化学式依次为H3PO4、H2SO4、
HClO4,
Cl的非金属性最强,则HClO4的酸性最强,故答案为:H3PO4;H2SO4;HClO4;HClO4;
(4)B、D同主族,气态氢化物的化学式依次为H2S、H2O,非金属性O>S,则稳定性H2O>H2S,H2S的还原性最强,
故答案为:H2S;H2O;H2O;H2S.
则
| x×2 |
| x×2+16×5 |
质子数等于原子序数,设原子序数为y,原子核内中子数比质子数多1个,中子数为y+1,
则y+(y+1)=31,解得y=15,即A为P元素,原子结构中有3个电子层,最外层有5个电子,
P位于元素周期表中的第三周期第ⅤA族,
故答案为:31;15;三;ⅤA;
(2)由元素在周期表中的位置可知,A、B、C同周期相邻元素,B、D为同主族元素,则B为S,C为Cl,D为O,
故答案为:P;S;Cl;O;
(3)A、B、C同周期,从左到右元素的非金属性在增强,三种元素最高价氧化物的水化物的化学式依次为H3PO4、H2SO4、
HClO4,
Cl的非金属性最强,则HClO4的酸性最强,故答案为:H3PO4;H2SO4;HClO4;HClO4;
(4)B、D同主族,气态氢化物的化学式依次为H2S、H2O,非金属性O>S,则稳定性H2O>H2S,H2S的还原性最强,
故答案为:H2S;H2O;H2O;H2S.
点评:本题考查位置、结构、性质的关系及其应用,A的推断是解答本题的关键,熟悉质量分数的计算及原子的构成、元素在周期表中的位置即可解答.

练习册系列答案
相关题目
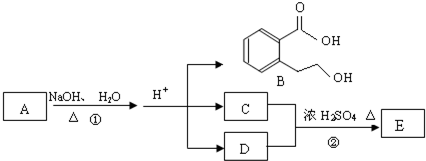

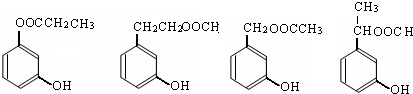


 (或CH2=CH2+H2O
(或CH2=CH2+H2O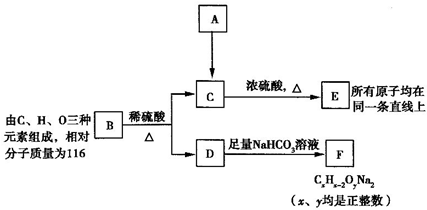
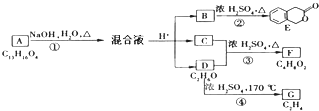
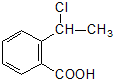 合成
合成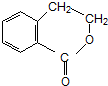 (用反应流程图表示,并注明反应条件)
(用反应流程图表示,并注明反应条件)