题目内容
现有Fe、Cu组成的合金,其中Cu、Fe的总物质的量为1mol,Cu的物质的量分数为x.研磨成粉末后,全部投入含b mol硝酸的稀溶液中,微热使其充分反应,还原产物只得到NO.试回答下列问题:(1)用微粒符号填写下列空白(列举出全部可能的情况).
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 残留固体成分 | Fe、Cu | Cu | Cu | - | - | - |
| 溶液中的金属离子 |
(3)若固体和硝酸恰好完全反应,被还原的硝酸占总量的1/4,则b的取值范围为______.
【答案】分析:(1)根据剩余固体的成分结合物质还原性强弱、离子共存分析;
(2)根据Fe2+及稀硝酸的性质分析;
(3)根据离子的成分采用极限法分析;?
解答:解:(1)Cu、Fe的混合物与稀硝酸反应,金属可能有剩余,可能没有剩余.金属可能有剩余时,根据共存可知,剩余金属有两种情况:①剩余Fe、Cu,当有Fe剩余时,溶液中能与Fe反应的Fe3+、Cu2+都不存在,所以溶液中只有Fe2+;
②只剩余Cu,溶液中一定不存在与Cu反应的Fe3+,根据离子共存,可能只有Fe2+;
③通过②知,溶液中还可能存在的离子是Fe2+、Cu2+;
④当固体没有剩余时,可能存在的情况是:当Fe恰好与硝酸反应生成Fe2+,Cu 恰好与硝酸生成Cu2+,所以溶液中存在的离子是Fe2+、Cu2+;
⑤通过④知,固体没有剩余时,生成的Fe3+部分反应,根据离子共存,溶液中存在的离子可能的Fe2+、Fe3+、Cu2+;
⑥通过④、⑤知,固体没有剩余时,铁、铜全部被氧化成离子,根据离子共存,溶液中存在的离子可能是Cu2+、Fe3+;
故答案为:
(2)硝酸有强氧化性,Fe2+有还原性,所以硝酸和Fe2+能发生氧化还原反应,把Fe2+氧化成Fe3+,自身被还原成一氧化氮,故答案为:3Fe2++4H++NO3-=3Fe3++NO↑+2H2O.
(3)当固体没有剩余时,根据离子共存,溶液中存在的离子可能情况分别为:Fe2+、Cu2+;Fe2+、Fe3+、Cu2+;Cu2+、Fe3+;
根据铁、铜与硝酸反应的比例关系分析知,当溶液中存在的离子为Fe2+、Cu2+时,消耗的硝酸最少;
3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O
3 8
(1-x)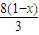
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
3 8
x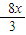
所以消耗硝酸的量为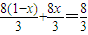 mol;
mol;
当铁恰好反应生成硝酸铁,铜恰好生成硝酸铜时,消耗的硝酸的量最多,
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
3 8
x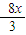
Fe+4HNO3=Fe(NO3)3+NO↑+2H2O
1 4
1-x 4( 1-x )
所以消耗硝酸的量为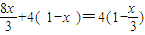 mol
mol
故答案为: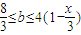
点评:本题考查了铁、铜及硝酸的性质,因为铁是变价金属,和硝酸反应又涉及量不同产物不同,所以本题难度较大,可根据固体成分结合离子共存讨论,化繁为简,效果较好.
(2)根据Fe2+及稀硝酸的性质分析;
(3)根据离子的成分采用极限法分析;?
解答:解:(1)Cu、Fe的混合物与稀硝酸反应,金属可能有剩余,可能没有剩余.金属可能有剩余时,根据共存可知,剩余金属有两种情况:①剩余Fe、Cu,当有Fe剩余时,溶液中能与Fe反应的Fe3+、Cu2+都不存在,所以溶液中只有Fe2+;
②只剩余Cu,溶液中一定不存在与Cu反应的Fe3+,根据离子共存,可能只有Fe2+;
③通过②知,溶液中还可能存在的离子是Fe2+、Cu2+;
④当固体没有剩余时,可能存在的情况是:当Fe恰好与硝酸反应生成Fe2+,Cu 恰好与硝酸生成Cu2+,所以溶液中存在的离子是Fe2+、Cu2+;
⑤通过④知,固体没有剩余时,生成的Fe3+部分反应,根据离子共存,溶液中存在的离子可能的Fe2+、Fe3+、Cu2+;
⑥通过④、⑤知,固体没有剩余时,铁、铜全部被氧化成离子,根据离子共存,溶液中存在的离子可能是Cu2+、Fe3+;
故答案为:
| ① | ② | ③ | ④ | ⑤ | ⑥ | |
| 溶液中的金属离子 | Fe2+ | Fe2+ | Fe2+、Cu2+ | Fe2+、Cu2+ | Fe2+、Fe3+、Cu2+ | Cu2+、Fe3+ |
(3)当固体没有剩余时,根据离子共存,溶液中存在的离子可能情况分别为:Fe2+、Cu2+;Fe2+、Fe3+、Cu2+;Cu2+、Fe3+;
根据铁、铜与硝酸反应的比例关系分析知,当溶液中存在的离子为Fe2+、Cu2+时,消耗的硝酸最少;
3Fe+8HNO3=3Fe(NO3)2+2NO↑+4H2O
3 8
(1-x)
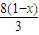
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
3 8
x
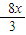
所以消耗硝酸的量为
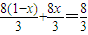 mol;
mol;当铁恰好反应生成硝酸铁,铜恰好生成硝酸铜时,消耗的硝酸的量最多,
3Cu+8HNO3=3Cu(NO3)2+2NO↑+4H2O
3 8
x
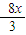
Fe+4HNO3=Fe(NO3)3+NO↑+2H2O
1 4
1-x 4( 1-x )
所以消耗硝酸的量为
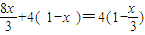 mol
mol故答案为:
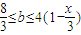
点评:本题考查了铁、铜及硝酸的性质,因为铁是变价金属,和硝酸反应又涉及量不同产物不同,所以本题难度较大,可根据固体成分结合离子共存讨论,化繁为简,效果较好.

练习册系列答案
相关题目
现有Fe、Cu组成的合金,其中Fe、Cu的总物质的量为a,Cu的物质的量分数为x。将合金研成粉末后,全部投入到含b HNO3的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO。试回答下列问题:
(1)用粒子符号填写下列空白(列举出全部可能的情况)
| ① | ② | ③ | ④ | … |
残留固体成分 |
|
|
|
|
|
溶液中的金属离子 |
|
|
|
|
|
(2)当溶液中金属离子只有Fe2+和Cu2+时,则b的取值范围是__________________(用a、x表示)。
(3)当x=0.5,溶液中Fe3+与Fe2+的物质的量相等时,在标准状况下共产生672 mL气体。求a、b的值。
现有Fe、Cu组成的合金,其中Cu、Fe的总物质的量为?a mol?,Cu物质的量分数为x;研成粉末后,全部投入含b mol HNO3的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:(已知:Cu+2Fe3+ 2Fe2++Cu2+)?
2Fe2++Cu2+)?
(1)随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有六种情况,请用粒子符号填写下列空白:
| ① | ② | ③ | ④ | ⑤ | ⑥ |
溶液中的金属离子 |
| Fe2+ |
| Fe2+ Cu2+ |
| Cu2+ Fe3+ |
残留固体成分 | Fe Cu |
| Cu | — | — | — |
(2)当溶液中金属离子只有Fe2+、Cu2+时,求b的取值范围。?
现有Fe、Cu组成的合金,其中Cu、Fe的总物质的量为amol,Cu的物质的量分数为x;研成粉末后,全部投入含bmol HNO3的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:(已知:Cu+2Fe3+=2Fe2++Cu2+)
(1)随HNO3用量的增加,溶液中的金属离子和残留固体的成分依次有六种情况,请用粒子符号填写下列空白:
| ① | ② | ③ | ④ | ⑤ | ⑥ |
溶液中的金属离子 |
| Fe2+ |
| Fe2+、Cu2+ |
| Cu2+、Fe3+ |
残留固体成分 | Fe、Cu |
| Cu | ―― | ―― | ―― |
(2)当溶液中金属离子只有Fe2+、Cu2+时,求b的取值范围。
(3)当x=0.5时,溶液中Fe3+与Fe2+的物质的量相等时,在标准状况共产生672mL气体。求a、b的值。
 的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题:
的稀溶液中,微热使其充分反应,且硝酸的还原产物只有NO,试回答下列问题: 、Cu
、Cu 与Fe
与Fe