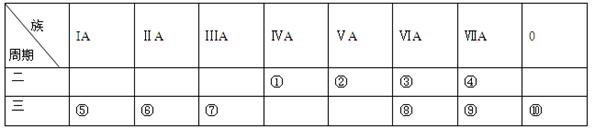
题目内容
A、B、C、D、E原子序数依次增大, A、B、E的位置如图所示,A、B两种元素的原子序数之和等于E的核电荷数,E原子核内质子数等于中子数; 1molC的单质跟足量盐酸反应,可置换出标准状况下22.4L的H2,这时C转变为与氖原子具有相同电子层结构的离子;在同一周期的元素形成的简单离子中D最小。请回答:

(1)用电子式表示B和C组成的化合物的形成过程为______________________;
(2)D离子的电子式是 ,A的氢化物的电子式是 ,E原子的化学符号 ;
(3)与E同族元素形成的气态氢化物中,沸点最高的是 ,(填氢化物化学式),原因是 ;
(4)B、E可能形成EB6型化合物,试从化合价角度说明该化合物能否燃烧 。

(1)用电子式表示B和C组成的化合物的形成过程为______________________;
(2)D离子的电子式是 ,A的氢化物的电子式是 ,E原子的化学符号 ;
(3)与E同族元素形成的气态氢化物中,沸点最高的是 ,(填氢化物化学式),原因是 ;
(4)B、E可能形成EB6型化合物,试从化合价角度说明该化合物能否燃烧 。
(1) MgF2 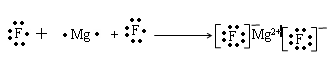 (2) Al3+
(2) Al3+ 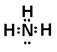
 S
S
(3) H2O H2O分子之间存在氢键
(4)不能燃烧。SF6硫元素为+6价,处于最高价态不能被氧化。虽然氟为-1价,但也不能被氧气氧化,所以不能燃烧
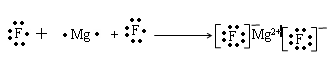 (2) Al3+
(2) Al3+ 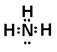
 S
S (3) H2O H2O分子之间存在氢键
(4)不能燃烧。SF6硫元素为+6价,处于最高价态不能被氧化。虽然氟为-1价,但也不能被氧气氧化,所以不能燃烧
试题分析:由题可以知道,A、B、C、D、E分别为N、F、Mg、Al、S。(1)B和C组成的化合物为 MgF2,用电子式表示其形成过程为:
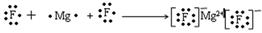 ,(2)D离子为Al,其电子式是Al3+,A的氢化物为氨气,其电子式为
,(2)D离子为Al,其电子式是Al3+,A的氢化物为氨气,其电子式为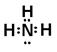 ,E原子的化学符号为
,E原子的化学符号为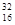 S ,(3)E为S,其同族H2O的沸点最高,是因为H2O分子之间存在氢键,(4)B、E可能形成EB6,即SF6,该化合物不能燃烧,因为SF6硫元素为+6价,处于最高价态不能被氧化。虽然氟为-1价,但也不能被氧气氧化,所以不能燃烧。
S ,(3)E为S,其同族H2O的沸点最高,是因为H2O分子之间存在氢键,(4)B、E可能形成EB6,即SF6,该化合物不能燃烧,因为SF6硫元素为+6价,处于最高价态不能被氧化。虽然氟为-1价,但也不能被氧气氧化,所以不能燃烧。点评:本题综合考查了多个知识点,是高考常考的考点,本题有一定的综合性,具有一定的难度。

练习册系列答案
 课课练江苏系列答案
课课练江苏系列答案 名牌中学课时作业系列答案
名牌中学课时作业系列答案
相关题目