题目内容
1.已知可逆反应:A(s)+2B(g)?C(g)+D(g)在一定温度下的定容密闭容器中,当物质的下列物理量不再变化时,表明该可逆反应已达到平衡状态的是( )①混合气体的压强 ②混合气体的密度 ③B的物质的量浓度 ④气体的总物质的量.
| A. | ①② | B. | ②③ | C. | ③④ | D. | ②④ |
分析 根据化学平衡状态的特征解答,当反应达到平衡状态时,正逆反应速率相等,各物质的浓度、百分含量不变,以及由此衍生的一些量也不发生变化,解题时要注意,选择判断的物理量,随着反应的进行发生变化,当该物理量由变化到定值时,说明可逆反应到达平衡状态.
解答 解:①两边的计量数相等,混合气体的压强始终不变,故①错误;
②混合气体的密度,说明气体的质量不变,反应达平衡状态,故②正确;
③B的物质的量浓度不变,说明正逆反应速率相等,故③正确;
④反应两边的计量数相等,气体的总物质的量始终不变,故④错误;
故选B.
点评 本题考查了化学平衡状态的判断,难度不大,注意当反应达到平衡状态时,正逆反应速率相等,但不为0.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
11.下表是元素周期表的一部分,请回答有关问题:
(1)表中化学性质最不活泼的元素,其原子结构示意图为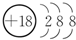 .
.
(2)表中能形成两性氢氧化物的元素是铝(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式2Al+2KOH+2H2O═2KAlO2+3H2↑.
(3)①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为KOH、Mg(OH)2、Al(OH)3、H2CO3、H2SO4、HClO4(用化学式表示).
(4)③元素与⑩元素两者核电荷数之差是26.
(5)请写出②的氢化物发生催化氧化的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(6)请写出⑤元素的最高价氧化物的水化物与⑦元素的最高价氧化物的水化物反应的离子方程式Al(OH)3+3H+═Al3++3H2O.
| 主族 周期 | ⅠA | ⅡA | ⅢA | ⅣA | ⅤA | ⅥA | ⅦA | 0 |
| 2 | ① | ② | ③ | |||||
| 3 | ④ | ⑤ | ⑥ | ⑦ | ⑧ | |||
| 4 | ⑨ | ⑩ |
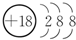 .
.(2)表中能形成两性氢氧化物的元素是铝(填元素名称),写出该元素的单质与⑨最高价氧化物的水化物反应的化学方程式2Al+2KOH+2H2O═2KAlO2+3H2↑.
(3)①、④、⑤、⑥、⑦、⑨六种元素的最高价氧化物的水化物中,按碱性减弱酸性增强的顺序排列为KOH、Mg(OH)2、Al(OH)3、H2CO3、H2SO4、HClO4(用化学式表示).
(4)③元素与⑩元素两者核电荷数之差是26.
(5)请写出②的氢化物发生催化氧化的化学方程式4NH3+5O2$\frac{\underline{催化剂}}{△}$4NO+6H2O.
(6)请写出⑤元素的最高价氧化物的水化物与⑦元素的最高价氧化物的水化物反应的离子方程式Al(OH)3+3H+═Al3++3H2O.
12.若M+N=F+G这一反应是放热反应,下列说法正确的是( )
| A. | M的能量比G高 | |
| B. | N的能量比G高 | |
| C. | 这一反应不需要加热一定能发生 | |
| D. | 反应物的能量之和大于生成物的能量之和 |
16.下列离子方程式错误的是( )
| A. | 硫酸氢钠溶液中加入氢氧化钠溶液:H++OH-=H2O | |
| B. | 氧化铜和稀盐酸:CuO+2H+=Cu2++H2O | |
| C. | 少量的NaHCO3与足量的NaOH溶液:HCO3-+OH-=CO32-+H2O | |
| D. | 少量的NaHCO3溶液与足量的Ca(OH)2溶液:2HCO3-+Ca2++2OH-=CaCO3↓+CO32-+2H2O |
6.乙酸乙酯在NaOH的重水(D2O)溶液中加热水解,其产物是( )
| A. | CH3COOD,C2H5OD | B. | CH3COONa,C2H5OD,HOD | ||
| C. | CH3COONa,C2H5OH,HOD | D. | CH3COONa,C2H5OD,H2O |
13.以石墨为电极,电解1L CuSO4和NaCl的混合溶液,其中CuSO4与NaCl的物质的量之和为0.2mol,CuSO4的物质的量占总物质的量的比值为a.下列说法正确的是( )
| A. | 若a=0.5,当Cu2+在阴极恰好全部析出时,产生的气体只有氯气 | |
| B. | 若a=0.5,当Cu2+在阴极恰好全部析出时,产生的气体的物质的量为0.1mol | |
| C. | 若a=0.2,当Cl-在阳极恰好全部逸出时,产生0.08mol的NaOH | |
| D. | 若电解一段时间后,阴、阳两极产生的气体的物质的量恰好均为0.16mol,则a=0.2 |
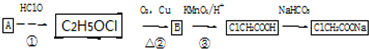
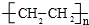 .
.