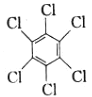
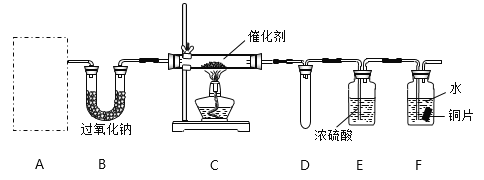
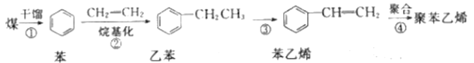题目内容
【题目】乙炔是有机合成工业的一种原料。工业上曾用CaC2与水反应生成乙炔。
(1)CaC2中C22-的电子式可表示为_____;1mol C22-中含有的![]() 键数目为________。
键数目为________。
(2)将乙炔通入[Cu(NH3)2Cl]溶液生成Cu2C2红棕色沉淀。Cu+基态核外电子排布式为___。
(3)乙炔与氢氰酸反应可得丙烯腈(H2C=CH-C≡N)。丙烯腈分子中碳原子轨道杂化类型是________;分子中处于同一直线上的原子数目最多为___________。
(4)CaC2晶体的晶胞结构与NaCl晶体的相似(如图所示),但CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长。CaC2晶体中1个Ca2+周围距离最近的C22-数目为_________。

【答案】![]() 2NA 1s22s22p63s23p63d10 sp杂化、sp2杂化 3 4
2NA 1s22s22p63s23p63d10 sp杂化、sp2杂化 3 4
【解析】
(1)CaC2中C22-的两个C原子之间形成三对共用电子对,所以电子式为![]() ;碳碳三键中有2个是
;碳碳三键中有2个是![]() 键,所以1mol C22-中含有的
键,所以1mol C22-中含有的![]() 键数目为2NA;
键数目为2NA;
(2)根据电子的排布规律,Cu+基态核外电子数是28个,失去4s上的1个电子,所以电子排布式为1s22s22p63s23p63d10;
(3)H2C=CH-C≡N分子中,碳氮三键的C原子的杂化方式是sp杂化,碳碳双键的C原子是sp2杂化;因为碳碳双键的键角是120度,碳氮三键键角是180度,所以分子中处于同一直线上的原子数目最多是3个;
(4)因为CaC2晶体中含有的中哑铃形C22-的存在,使晶胞沿一个方向拉长,所以晶胞的形状不是正方体,上下底面是正方形,所以CaC2晶体中1个Ca2+周围距离最近的C22-只有与Ca2+同层的4个C22-,离Ca2+的距离最近且相等,则CaC2晶体中1个Ca2+周围距离最近的C22-数目为4.

 芝麻开花课程新体验系列答案
芝麻开花课程新体验系列答案【题目】对燃煤烟气和汽车尾气进行脱硝、脱碳和脱硫等处理,可实现绿色环保、节能减排等目的。汽车尾气脱硝脱碳的主要原理为:2NO(g)+2CO(g)![]() N2(g)+2CO2(g)△H=-Q(Q>0)。一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
N2(g)+2CO2(g)△H=-Q(Q>0)。一定条件下,在一密闭容器中,用传感器测得该反应在不同时间的NO和CO浓度如下表:
时间/s | 0 | 1 | 2 | 3 | 4 | 5 |
c(NO)/mol·L-1 | 1.00×10-3 | 4.50×10-4 | 2.50×10-4 | 1.50×10-4 | 1.00×10-4 | 1.00×10-4 |
c(CO)/mol·L-1 | 3.60×10-3 | 3.05×10-3 | 2.85×10-3 | 2.75×10-3 | 2.70×10-3 | 2.70×10-3 |
(1)写出该反应的平衡常数表达式____________________。
(2)前2s内的平均反应速率υ(N2)=__________;达到平衡时,CO的转化率为___________。
(3)采用低温臭氧氧化脱硫脱硝技术,同时吸收SO2和NOx,获得(NH4)2SO4的稀溶液,往(NH4)2SO4溶液中再加入少量 (NH4)2SO4固体,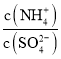 的值将_______(填 “变大”、“不变”或“变小”)。
的值将_______(填 “变大”、“不变”或“变小”)。
【题目】下列实验操作以及实验现象完全一致的是( )
A | 向硫酸铜溶液中加入一小块金属钠 | 有红色固体析出 |
B | 向饱和碳酸钠溶液中通入过量 | 有白色固体析出 |
C | 将新制的氯水滴到蓝色石蕊试纸上 | 试纸变红 |
D | 将用砂纸打磨过的铝箔置于酒精灯火焰上加热 | 铝熔化并滴落下来 |
A.AB.BC.CD.D