题目内容
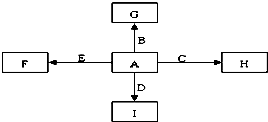 A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物.已知:
①反应C+G B+H能放出大量的热,该反应曾应用于铁轨的焊接;
B+H能放出大量的热,该反应曾应用于铁轨的焊接;
②I是一种常见的温室气体,它和E可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%.回答问题:
2F+D,F中的E元素的质量分数为60%.回答问题:
(1)①中反应的化学方程式为______;
(2)化合物Ⅰ的电子式为______;
(3)1.6g G 溶于盐酸,得到的溶液与铜粉完全反应,计算至少所需铜粉的质量______;
(4)C与过量NaOH溶液反应的化学方程式为______,反应后溶液与过量化合物Ⅰ反应的化学方程式为______;
(5)E在I中燃烧可能观察到的现象是______.
解:A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,
①反应C+G B+H能放出大量的热,该反应曾应用于铁轨的焊接,该反应为铝热反应,则C为Al,B为Fe,G为Fe2O3,H为Al2O3,
B+H能放出大量的热,该反应曾应用于铁轨的焊接,该反应为铝热反应,则C为Al,B为Fe,G为Fe2O3,H为Al2O3,
②I是一种常见的温室气体,则I为CO2,它和E可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%,则E为Mg,D为C,F为MgO,由图中转化可知,A为O2.
2F+D,F中的E元素的质量分数为60%,则E为Mg,D为C,F为MgO,由图中转化可知,A为O2.
(1)①中反应的化学方程式为2Al+Fe2O3 Al2O3+2Fe,故答案为:2Al+Fe2O3
Al2O3+2Fe,故答案为:2Al+Fe2O3 Al2O3+2Fe;
Al2O3+2Fe;
(2)I为二氧化碳,其电子式为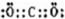 ,为直线型分子,故答案为:
,为直线型分子,故答案为: ;
;
(3)1.6g G其物质的量为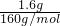 =0.01mol,由Fe2O3~2Fe3+~Cu可知,需要Cu的质量为0.01mol×64g/mol=0.64g,故答案为:0.64g;
=0.01mol,由Fe2O3~2Fe3+~Cu可知,需要Cu的质量为0.01mol×64g/mol=0.64g,故答案为:0.64g;
(4)C与过量NaOH溶液反应的化学方程式为为2Al+2OH-+2H2O=2AlO2-+3H2↑,反应后溶液与过量化合物Ⅰ反应的化学方程式为AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;
(5)E在I中燃烧可能观察到的现象是镁条剧烈燃烧,生成白色粉末,反应器内壁附着有黑色的碳,故答案为:镁条剧烈燃烧,生成白色粉末,反应器内壁附着有黑色的碳.
分析:A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,
①反应C+G B+H能放出大量的热,该反应曾应用于铁轨的焊接,该反应为铝热反应,则C为Al,B为Fe,G为Fe2O3,H为Al2O3,
B+H能放出大量的热,该反应曾应用于铁轨的焊接,该反应为铝热反应,则C为Al,B为Fe,G为Fe2O3,H为Al2O3,
②I是一种常见的温室气体,则I为CO2,它和E可以发生反应:2E+I 2F+D,F中的E元素的质量分数为60%,则E为Mg,D为C,F为MgO,由图中转化可知,A为O2.
2F+D,F中的E元素的质量分数为60%,则E为Mg,D为C,F为MgO,由图中转化可知,A为O2.
然后结合元素化合物知识及化学用语来解答.
点评:本题考查无机物的推断,注意利用铝热反应及温室效应气体、Mg与二氧化碳的反应为解答本题的突破口,熟悉Mg、Al及其化合物的性质及氧化还原反应即可解答,题目难度中等.
①反应C+G
 B+H能放出大量的热,该反应曾应用于铁轨的焊接,该反应为铝热反应,则C为Al,B为Fe,G为Fe2O3,H为Al2O3,
B+H能放出大量的热,该反应曾应用于铁轨的焊接,该反应为铝热反应,则C为Al,B为Fe,G为Fe2O3,H为Al2O3,②I是一种常见的温室气体,则I为CO2,它和E可以发生反应:2E+I
 2F+D,F中的E元素的质量分数为60%,则E为Mg,D为C,F为MgO,由图中转化可知,A为O2.
2F+D,F中的E元素的质量分数为60%,则E为Mg,D为C,F为MgO,由图中转化可知,A为O2.(1)①中反应的化学方程式为2Al+Fe2O3
 Al2O3+2Fe,故答案为:2Al+Fe2O3
Al2O3+2Fe,故答案为:2Al+Fe2O3 Al2O3+2Fe;
Al2O3+2Fe;(2)I为二氧化碳,其电子式为
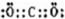 ,为直线型分子,故答案为:
,为直线型分子,故答案为: ;
;(3)1.6g G其物质的量为
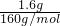 =0.01mol,由Fe2O3~2Fe3+~Cu可知,需要Cu的质量为0.01mol×64g/mol=0.64g,故答案为:0.64g;
=0.01mol,由Fe2O3~2Fe3+~Cu可知,需要Cu的质量为0.01mol×64g/mol=0.64g,故答案为:0.64g;(4)C与过量NaOH溶液反应的化学方程式为为2Al+2OH-+2H2O=2AlO2-+3H2↑,反应后溶液与过量化合物Ⅰ反应的化学方程式为AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓,
故答案为:2Al+2OH-+2H2O=2AlO2-+3H2↑;AlO2-+CO2+2H2O=HCO3-+Al(OH)3↓;
(5)E在I中燃烧可能观察到的现象是镁条剧烈燃烧,生成白色粉末,反应器内壁附着有黑色的碳,故答案为:镁条剧烈燃烧,生成白色粉末,反应器内壁附着有黑色的碳.
分析:A、B、C、D、E是单质,G、H、I、F是B、C、D、E分别和A形成的二元化合物,
①反应C+G
 B+H能放出大量的热,该反应曾应用于铁轨的焊接,该反应为铝热反应,则C为Al,B为Fe,G为Fe2O3,H为Al2O3,
B+H能放出大量的热,该反应曾应用于铁轨的焊接,该反应为铝热反应,则C为Al,B为Fe,G为Fe2O3,H为Al2O3,②I是一种常见的温室气体,则I为CO2,它和E可以发生反应:2E+I
 2F+D,F中的E元素的质量分数为60%,则E为Mg,D为C,F为MgO,由图中转化可知,A为O2.
2F+D,F中的E元素的质量分数为60%,则E为Mg,D为C,F为MgO,由图中转化可知,A为O2.然后结合元素化合物知识及化学用语来解答.
点评:本题考查无机物的推断,注意利用铝热反应及温室效应气体、Mg与二氧化碳的反应为解答本题的突破口,熟悉Mg、Al及其化合物的性质及氧化还原反应即可解答,题目难度中等.

练习册系列答案
相关题目
已知A、B、C、D、E是短周期原子序数依次增大的五种元素,A原子在元素周期表中原子半径最小,B与E同主族,且E的原子序数是B的两倍,C、D是金属,它们的氢氧化物均难溶于水.下列说法不正确的是( )
| A、简单离子的半径:C>D>E>B | B、工业上常用电解法制得C和D的单质 | C、稳定性:A2B>A2E | D、单质D可用于冶炼某些难熔金属 |

 2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
2DB3,若3.2gDB2完全转化为DB3气体时放热akJ;1mol DB3气体完全转化为其水化物放热bkJ,则标况下33.6L DB2完全完成上述两步反应放热
