题目内容
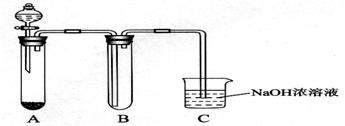
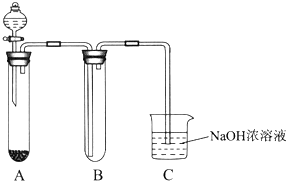 某课外小组同学用下图所示装置进行实验(夹持装置已省略).
某课外小组同学用下图所示装置进行实验(夹持装置已省略).(1)用该装置制备NO2并研究其性质.
①收集一试管NO2,取下试管B倒立在水中,观察到的现象是
②该反应的化学方程式是
③C中NaOH溶液吸收NO2,生成两种盐,且被氧化与被还原的NO2的物质的量之比是1:1,请写出该反应的离子方程式
(2)该装置也可用于制备Cl2并研究其性质.
①若A中固体为漂白粉,滴入浓盐酸,则A中发生反应的化学方程式是
②在B中放一小块湿润的淀粉碘化钾试纸,可观察到试纸变蓝,请结合离子方程式解释原因
③硫代硫酸钠(Na2S2O3)可替代NaOH溶液吸收氯气,已知25.0mL 0.1mol?L-1的Na2S2O3溶液恰好把标准状况下224mL Cl2完全转化为Cl-时,S2O32-转化成
a.S2- b.S c.SO32- d.SO42-.
分析:(1)①二氧化氮为红棕色气体,能和水反应生成硝酸和无色的一氧化氮气体;
②根据反应物和生成物写出反应方程式;
③NaOH溶液吸收NO2,生成两种盐,二氧化氮被氧化生成硝酸根离子,被氧化与被还原的NO2的物质的量之比是1:1,则被还原生成亚硝酸根离子,据此写出离子方程式;
(2)①次氯酸钙和浓盐酸反应生成氯化钙、氯气和水;
②氯气具有强氧化性,能氧化碘离子生成碘单质,碘遇淀粉试液变蓝色;
③根据转移电子相等确定生成物.
②根据反应物和生成物写出反应方程式;
③NaOH溶液吸收NO2,生成两种盐,二氧化氮被氧化生成硝酸根离子,被氧化与被还原的NO2的物质的量之比是1:1,则被还原生成亚硝酸根离子,据此写出离子方程式;
(2)①次氯酸钙和浓盐酸反应生成氯化钙、氯气和水;
②氯气具有强氧化性,能氧化碘离子生成碘单质,碘遇淀粉试液变蓝色;
③根据转移电子相等确定生成物.
解答:解:(1)①二氧化氮为红棕色气体,能和水反应生成硝酸和无色的一氧化氮气体,导致试管内气体压强减小,液面上升,气体颜色由红棕色变为无色,所以看到的现象是:液面上升,红棕色气体变为无色,
故答案为:液面上升,红棕色气体变为无色;
②二氧化氮和水反应生成硝酸和一氧化氮,反应方程式为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
③NaOH溶液吸收NO2,生成两种盐,二氧化氮被氧化生成硝酸根离子,被氧化与被还原的NO2的物质的量之比是1:1,则被还原生成亚硝酸根离子,根据元素守恒知,生成物中还有水,离子反应方程式为:2NO2+2OH-=NO2-+NO3-+H2O,故答案为:2NO2+2OH-=NO2-+NO3-+H2O;
(2)①次氯酸钙具有强氧化性,能氧化浓盐酸生成氯气,同时还生成氯化钙和水,所以反应方程式为:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,
故答案为:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
②氯气具有强氧化性,能将碘离子氧化生成碘单质,离子反应方程式为Cl2+2I-=2Cl-+I2,碘遇湿润的淀粉碘化钾试纸变蓝色,
故答案为:Cl2+2I-=2Cl-+I2,I-被氧化为I2,遇淀粉变蓝;
③n(Na2S2O3)=0.1mol/L×0.025L=0.0025mol,氯气的物质的量=
=0.01mol,二者完全反应时转移电子相等,设硫代硫酸根离子被氧化后硫元素的化合价为x,
0.01mol×2×(1-0)=0.0025mol×2×(x-2),4=x-2,x=+6,所以硫代硫酸根离子转化为硫酸根离子,故选d.
故答案为:液面上升,红棕色气体变为无色;
②二氧化氮和水反应生成硝酸和一氧化氮,反应方程式为:3NO2+H2O=2HNO3+NO,
故答案为:3NO2+H2O=2HNO3+NO;
③NaOH溶液吸收NO2,生成两种盐,二氧化氮被氧化生成硝酸根离子,被氧化与被还原的NO2的物质的量之比是1:1,则被还原生成亚硝酸根离子,根据元素守恒知,生成物中还有水,离子反应方程式为:2NO2+2OH-=NO2-+NO3-+H2O,故答案为:2NO2+2OH-=NO2-+NO3-+H2O;
(2)①次氯酸钙具有强氧化性,能氧化浓盐酸生成氯气,同时还生成氯化钙和水,所以反应方程式为:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O,
故答案为:Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O;
②氯气具有强氧化性,能将碘离子氧化生成碘单质,离子反应方程式为Cl2+2I-=2Cl-+I2,碘遇湿润的淀粉碘化钾试纸变蓝色,
故答案为:Cl2+2I-=2Cl-+I2,I-被氧化为I2,遇淀粉变蓝;
③n(Na2S2O3)=0.1mol/L×0.025L=0.0025mol,氯气的物质的量=
| 0.224L |
| 22.4L/mol |
0.01mol×2×(1-0)=0.0025mol×2×(x-2),4=x-2,x=+6,所以硫代硫酸根离子转化为硫酸根离子,故选d.
点评:本题考查了性质实验方案设计,根据物质的性质结合氧化还原反应来分析解答,氧化还原反应中得失电子相等,题目难度不大.

练习册系列答案
 名师伴你成长课时同步学练测系列答案
名师伴你成长课时同步学练测系列答案
相关题目