题目内容
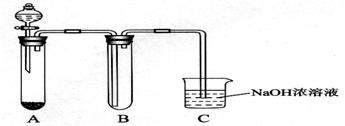
某课外小组同学用下图所示装置进行实验(夹持装置已省略)。

(1)用该装置制备NO2并研究其性质。
①收集一试管NO2,取下试管B倒立在水中,观察到的现象是________________。
②该反应的化学方程式是________________________________。
③C中NaOH溶液吸收NO2,生成两种盐,且被氧 化与被还原的NO2的物质的量之比是1:1,请写出该反应的离子方程式________________________________。
(2)该装置也可用于制备Cl2并研究其性质。
①若A中固体为漂白粉,滴入浓盐酸,则A中发生反应的化学方程式是___________。
②在B中放一小块湿润的淀粉碘化钾试纸,可观察到试纸变蓝,请结合离子方程式解释原因________________________________________。
③硫代硫酸钠(Na2S2O3)可替代NaOH溶液吸收氯气,已知25.0mL 0.1 mol·L-1的Na2S2O3溶液恰好把标准状况下224 mL Cl2完全转化为Cl-时,S2O32-转化成_____(填选项)。
a. S2- b. S c. SO32- d. SO42-
(12分,每空2分)(1)①液面上升,红棕色气体变为无色
②3NO2+H2O=2HNO3+NO ③2NO2+2OH-=NO2-+NO3-+H2O
(2)①Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O
②Cl2+2I-=2Cl-+I2 I-被氧化为I2,遇淀粉变蓝 ③d
【解析】
试题分析:(1)①NO2溶于水生成硝酸和NO,所以收集一试管NO2,取下试管B倒立在水中,观察到的现象是液面上升,红棕色气体变为无色。
②该反应的化学方程式是3NO2+H2O=2HNO3+NO。
③由于被氧化与被还原的NO2的物质的量之比是1:1,所以生成的硝酸钠和亚硝酸钠的物质的量之比是1:1的,则该反应的离子方程式是2NO2+2OH-=NO2-+NO3-+H2O。
(2)①漂白粉的有效成分是次氯酸钙,次氯酸钙具有强氧化性,能把浓盐酸氧化生成氯气,反应的化学方程式是Ca(ClO)2+4HCl(浓)=CaCl2+2Cl2↑+2H2O。
②氯气具有强氧化性,I-被氧化为I2,遇淀粉变蓝,反应的离子方程式是Cl2+2I-=2Cl-+I2。
③Na2S2O3中S元素的化合价是+2价,设氧化产物中S元素的化合价是n,则根据电子的得失守恒可知,0.025×0.1×(n-2)×2=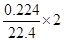 ,解得n=6,即氧化产物是硫酸钠,答案选d。
,解得n=6,即氧化产物是硫酸钠,答案选d。
考点:考查NO2的性质、氯气的制备、氧化还原反应的有关判断和计算、方程式的书写
点评:该题是中等难度的试题,也是高考中的常见题型。试题紧扣教材,贴近高考,有利于调动学生的学习兴趣,激发学生的学习积极性。也有利于培养学生的逻辑推理能力和发散思维能力,提升学生的学科素养。

 全能测控期末小状元系列答案
全能测控期末小状元系列答案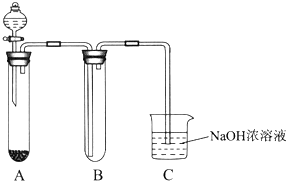 某课外小组同学用下图所示装置进行实验(夹持装置已省略).
某课外小组同学用下图所示装置进行实验(夹持装置已省略).