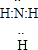题目内容
下列叙述正确的是
- A.用惰性电极电解滴有紫色石蕊试液的饱和食盐水,阴极区附近溶液先变红
- B.镀锌的铁制品,镀层部分受损后,露出的铁表面易被腐蚀
- C.用惰性电极电解CuSO4溶液,在电解片刻后溶液中加Cu(OH)2固体能使CuSO4溶液恢复到电解前浓度
- D.配置FeCl3溶液时,可先将其溶解在盐酸中,再用蒸馏水稀释
D
A中阴极是氢离子放电,阴极周围溶液显碱性,显蓝色,A不正确。锌比铁活泼,所以即使镀层部分受损后,露出的铁如果构成原电池,也是正极,被保护,B不正确。用惰性电极电解CuSO4溶液,从溶液中析出的是氧气和铜,所以在电解片刻后溶液中应该加氧化铜使溶液恢复到电解前浓度,C不正确。铁离子易水解,所以配制时用盐酸是为了防止其水解,D正确。答案选D。
A中阴极是氢离子放电,阴极周围溶液显碱性,显蓝色,A不正确。锌比铁活泼,所以即使镀层部分受损后,露出的铁如果构成原电池,也是正极,被保护,B不正确。用惰性电极电解CuSO4溶液,从溶液中析出的是氧气和铜,所以在电解片刻后溶液中应该加氧化铜使溶液恢复到电解前浓度,C不正确。铁离子易水解,所以配制时用盐酸是为了防止其水解,D正确。答案选D。

练习册系列答案
相关题目
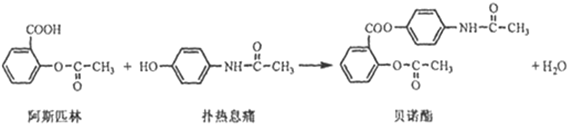
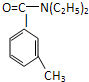 避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH
避蚊胺(又名DEET)是一种对人安全、活性高且无抗药性的新型驱蚊剂,其结构简式为:已知:RCOOH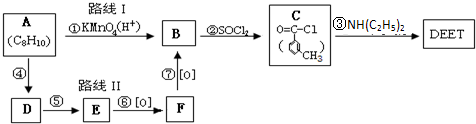


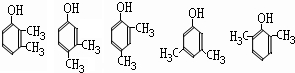 (任写2种)
(任写2种)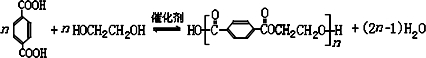

 NH3?H2O+H+
NH3?H2O+H+ (2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.
(2010?崇文区二模)X、Y、Z、W均为含有10电子的微粒,其中X、Y、Z为分子,W为离子,且X与Z分子中含有的共用电子对数之比为3:4.