题目内容
1.(l)某科研小组研究在其他条件不变的情况下.改变起始氢氧物质的量[用n(H2)表示]对N2(g)+3H2(g)?2NH3(g)△H<0反应的影响.实验结果可表示成如下图所示的规律(图中T表示温度.n表示物质的量):①比较在a、b、c三点所处的平衡状态中.反应物N2的转化率最高的是c点.
②若容器容积为1L.开始时只加人氮气和氢气,且n(H2)=3mol.反应达到平衡时.H2、N2的转化率均为60%.此条件下(T2).反应的平衡常数K=2.08(mol/L)-2(精确到0.01).
③图象中T2低于T1(填“高于”、“低于”“等于.或“无法确定”).
(2)液氨作为一种潜在的清洁汽车燃料已越来越被研究人员重视.它在安全性、价格等方面较化石燃料和氢燃料有着较大的优势.氨在燃烧试验中相关的反应有:
4NH3(g)+3O2(g)═2N2(g)+6H2O(l)△H1 ①
4NH3(g)+5O2(g)═4NO(g)+6H2O(l)△H2 ②
4NH3(g)+6NO(g)═5N2(g)+6H2O(l)△H3 ③
请写出上述三个反应中三者之间关系的表达式:△H1=$\frac{3△{H}_{2}+2△{H}_{3}}{5}$.
(3)Allis-Chalmers制造公司发现可以用氨作为燃料电池的燃料.其总反应式为4NH3+3O2═2N2+6H2O.正极上的电极反应式为O2+2H2O+4e-═4OH-,则负极上的电极反应式为2NH3+6OH--6e-=N2+6H2O.
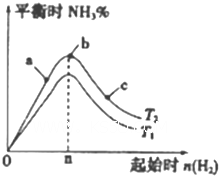
分析 (1)①三点时温度相同,氢气量越大,氮气的转化率越大;
②N2(g)+3H2(g)?2NH3(g)
起始 x 3 0
转化 0.6 1.8 1.2
平衡x-0.6 1.2 1.2
N2的转化率为60%,则$\frac{0.6mol}{x}$×100%=60%,解得x=1mol,
据此求算平衡常数;
③由图可知,其它条件相同时,T1先达到平衡且平衡时氨气的浓度小;
(2)利用已知的反应及盖斯定律来分析三个反应中△H1、△H2、△H3三者之间关系;
(3)氧气在正极上放电,结合碱性环境写出正极反应.
解答 解:(1)①三点时温度相同,氢气量越大,氮气的转化率越大,则c点的转化率最高,故答案为:c;
②N2(g)+3H2(g)?2NH3(g)
起始 x 3 0
转化0.6 1.8 1.2
平衡x-0.6 1.2 1.2
N2的转化率为60%,则$\frac{0.6mol}{x}$×100%=60%,解得x=1mol,
反应的平衡常数K=$\frac{[1.2mol/L]^{2}}{0.4mol/L×[1.2mol/L]^{3}}$=2.08(mol/L)-2,
故答案为:2.08(mol/L)-2;
③由图可知,其它条件相同时,T1先达到平衡且平衡时氨气的浓度小,则T2低于T1,故答案为:低于;
(2)由反应4NH3(g)+3O2(g)=2N2(g)+6H2O(l)△H1 ①
4NH3(g)+5O2(g)=4NO(g)+6H2O(l)△H2 ②
4NH3(g)+6NO(g)=5N2(g)+6H2O(l)△H3③
则反应(②×3+③×2)÷5可得到反应①,则△H1=$\frac{3△{H}_{2}+2△{H}_{3}}{5}$,故答案为:△H1=$\frac{3△{H}_{2}+2△{H}_{3}}{5}$;
(3)由总反应4NH3+3O2=2N2+6H2O,可知氧气在正极上放电,由于电解质是碱性的,故正极反应为:O2+2H2O+4e-=4OH-,所以负极的电极反应式为2NH3+6OH--6e-=N2+6H2O,
故答案为:2NH3+6OH--6e-=N2+6H2O.
点评 本题考查了化学平衡的计算、盖斯定律的应用和电极反应的书写,题目综合性较大,较难,是对知识的综合利用、注意基础知识的理解掌握.

| A. | CO和CH3OH | B. | CO2和H20 | C. | H2和CO2 | D. | CH3OH和H2 |
| A. | Cl2+H2O═HCl+HClO | B. | 2Na2O2+2H2O═4NaOH+O2↑ | ||
| C. | 2Na+2H2O═4NaOH+H2↑ | D. | 2H2O═2H2↑+O2↑ |
| 1 | 将X与Y用导线连接,浸入电解质溶液中,Y极上有气泡产生 |
| 2 | 将片状X、W分别投入等浓度的稀盐酸中都有气体产生,W比X反应剧烈 |
| 3 | 用惰性电极电解等物质的量浓度的Y和Z的硝酸盐混合溶液,在阴极上首先析出Z |
| A. | 上述四种金属中,Z的单质还原性最弱 | |
| B. | w的还原性强于Y的还原性 | |
| C. | Z放人CuSO4溶液中一定有Cu析出 | |
| D. | 用X、Z和稀硫酸可构成原电池,X作负极 |
 以下为五种有机物的有关信息,根据表中信息回答问题.
以下为五种有机物的有关信息,根据表中信息回答问题.| A | B | D | E | F |
| ①由C、H、O 三种元素组成的液体; ②与水任意比例互溶. | 其产量用来衡量一个国家的石油化工水平. | 比例模型为: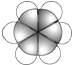 | ①可用于除水垢 ②在低于16.6℃时,凝固成冰一样的晶体. | 由5个原子组成的10个电子的共价分子. |
①有毒 ②无色无味 ③密度比水小 ④与酸性高锰酸钾溶液反应使其褪色
⑤在海带提碘实验中作萃取剂从碘水中提取碘单质
⑥在热Cu丝作用下生成相对分子质量比它小2的有机物
A.①③⑤B.②③④C.③④⑥D.④⑤⑥
(2)B的电子式为
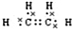 ,把一定体积的B、F混合气体通过溴水,有加成反应(填反应类型)发生,当溴水的质量增加2.8g时,生成物的质量为18.8g.(可能用到的相对原子质量:H 1;C 12;O 16;Br 80)
,把一定体积的B、F混合气体通过溴水,有加成反应(填反应类型)发生,当溴水的质量增加2.8g时,生成物的质量为18.8g.(可能用到的相对原子质量:H 1;C 12;O 16;Br 80)(3)工业上,D来源于煤干馏(填操作名称)后的液态产物煤焦油.D在浓硫酸、50~60℃水浴中与浓硝酸发生取代反应,生成的有机物的结构简式为
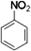 .
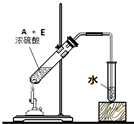
.(4)写出用18O标记的A与不含18O的E在一定条件下发生反应的化学方程式(注明反应条件).
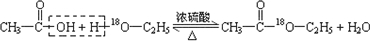 .
.如图为实验室进行该反应时的装置图,其中有4处错误.
 、
、 、
、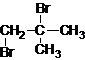 .
. .
.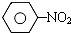 $\stackrel{Fe、HCl、H_{2}O}{→}$
$\stackrel{Fe、HCl、H_{2}O}{→}$
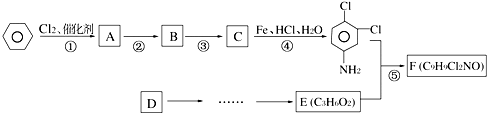
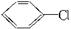 .反应②条件为浓硫酸加热.
.反应②条件为浓硫酸加热.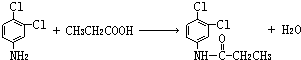 ;该反应的反应类型为取代反应.
;该反应的反应类型为取代反应. 实验室欲配制980mL0.100mol•L-1Na2CO3溶液,需要用到下列仪器:烧杯、量筒、药匙、玻璃棒、托盘天平
实验室欲配制980mL0.100mol•L-1Na2CO3溶液,需要用到下列仪器:烧杯、量筒、药匙、玻璃棒、托盘天平