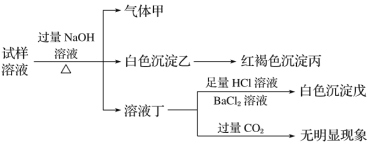
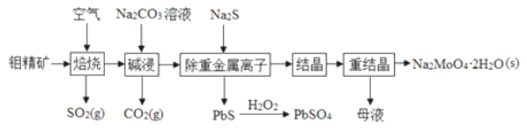
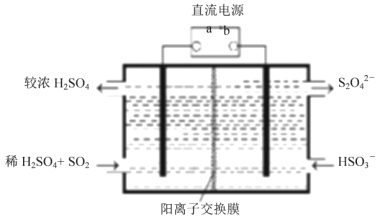
题目内容
【题目】已知1,3-丁二烯和Br2 以物质的量之比为 1∶1 加成时的反应方程式和对应过程的能量变化曲线如图所示。下列说法不正确的是
1,2-加成:![]() +Br2→
+Br2→![]() (产物A)
(产物A)
1,4-加成:![]() +Br2→
+Br2→![]() (产物B)
(产物B)
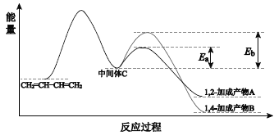
A.1,3-丁二烯和Br2 的加成反应是放热反应
B.其他条件相同时,生成产物A 的反应速率快于生成产物 B 的
C.其他条件相同时,产物A 比产物B 更稳定
D.改变反应温度可能改变产物A 和产物B 的比例
【答案】C
【解析】
A.从图中可知,不管发生1,2-加成还是1,4-加成,反应物的总能量均高于生成物的总能量,故反应1,3-丁二烯和Br2的加成反应是放热反应,故A说法正确;
B.活化能越小,反应越容易进行,反应速率越快,根据图知,1,2-加成所需活化能小于1,4-加成,则反应速率1,2-加成较快,故其他条件相同时,生成产物A 的反应速率快于生成产物 B 的,故B说法正确;
C.物质能量越低越稳定,即由图中可知产物A的总能量>产物B的,所以稳定性:A<B,故C说法错误;
D.从图中可知,生成A的活化能比生成B的小,化学反应速率快,所以低温时,产物以A为主;升高温度,体系的能量增加,中间体C转化为B的活化分子百分数增加,故生成产物B的几率增大了,因此,改变反应温度可能改变产物A 和产物B 的比例,故D说法正确;
故答案为:C。

练习册系列答案
相关题目