题目内容
【题目】硝基苯是重要的有机中间体,实验室制取少量硝基苯的装置如图所示。
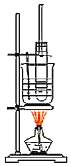
(1)写出制取硝基苯的化学方程式_____。
(2)该实验先在大试管中配制混合酸,配制混合酸的注意事项是_____并及时冷却。及时冷却的可能原因是_____。
(3)长玻璃导管兼做冷凝管,冷凝的是_____(填“物质名称”)。
(4)将除去混酸后的粗硝基苯先用冷水洗涤,再用10%碳酸钠溶液洗至不显酸性,最后用水洗至中性。洗涤和分离粗硝基苯的仪器是_____(填仪器名称)。检验最后用水洗至中性的操作是_____。
(5)经上述洗涤的硝基苯中仍含少量的苯等杂质,提纯硝基苯的方法是_____。硝基苯有毒,如果少量的液体溅在皮肤上,应用_____擦洗。
A.苯 B.酒精 C.硫酸 D.水
【答案】![]() +HO-NO2
+HO-NO2![]()
![]() +H2O 将浓硫酸滴加到浓硝酸中,且边滴边振荡 防止硝酸分解 苯和硝酸 分液漏斗 用胶头滴管(或玻棒)取最后一次洗涤液,滴到pH试纸上,测得pH=7 蒸馏 B
+H2O 将浓硫酸滴加到浓硝酸中,且边滴边振荡 防止硝酸分解 苯和硝酸 分液漏斗 用胶头滴管(或玻棒)取最后一次洗涤液,滴到pH试纸上,测得pH=7 蒸馏 B
【解析】
(1)浓硝酸和苯在浓硫酸作用下加热反应生成硝基苯,该反应的化学方程式为:![]() +HO-NO2
+HO-NO2![]()
![]() +H2O,故答案为:
+H2O,故答案为:![]() +HO-NO2
+HO-NO2![]()
![]() +H2O;
+H2O;
(2)浓硫酸溶于水温度升高,容易使液体飞溅,混合时应将浓硫酸滴加到浓硝酸中,且边滴边振荡,并及时冷却,其目的是加快热量散发防止硝酸分解,故答案为:将浓硫酸滴加到浓硝酸中,且边滴边振荡;防止硝酸分解;
(3)苯和硝酸沸点较低,易挥发,可用长玻璃导管冷凝,故答案为:苯和硝酸;
(4)硝基苯和水互不相溶,可用分液的方法分离,可用pH试纸测定溶液的酸碱性,用胶头滴管(或玻棒)取最后一次洗涤液,滴到pH试纸上,测得pH=7,故答案为:分液漏斗;用胶头滴管(或玻棒)取最后一次洗涤液,滴到pH试纸上,测得pH=7;
(5)硝基苯和苯沸点不同,可用蒸馏的方法分离;酒精与硝基苯混溶,如果少量的液体溅在皮肤上,应用酒精洗涤,但不能用苯和硫酸,苯对人体有害,故答案为:蒸馏;B。