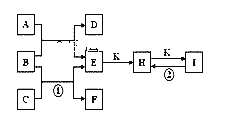
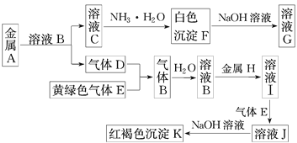
��Ŀ����
����Ŀ������˵���в���ȷ���У� ��
���������ռ���Һ��ʯ���鷴Ӧ���ܵõ�������������
�ڲⶨ������ˮ��pHʱ�����ò�����պȡҺ�����pH��ֽ�ϣ��������ɫ������
��������ֱ�Ӽ���ʳ�������Ƿ��е�Ԫ�أ�
��pH��5.6��7.0֮��Ľ�ˮͨ����Ϊ���ꣻ
�ݼ���Ba(NO3)2��Һ�����ɰ�ɫ��������ϡ�����������ʧ����ȷ����SO![]() ����
����
��SO2ͨ����ɫʯ����Һ����Һ�ȱ�����ɫ
������һ�����ʵ���Ũ�ȵ�����������Һ�����ձ������������ˮ�ܽ⣬δ��ȴ�����±�ת�Ƶ�����ƿ�У����½��ƫ��
��ֽ��������������������Թ��ڱ��ϵĺ�ɫ���ʿ���ϡ����ϴ�ӣ�
������AlCl3��Һ�ɵô�������ˮ�Ȼ�����
��2H2(g)+O2(g)=2H2O(g) ��H1��2H2(g)+O2(g) =2H2O(l) ��H2���H1����H2��
A.5��B.6��C.7��D.8��
���𰸡�C
��������
��Cl2��NaOH��Ӧ�ɵõ�NaClO��Cl2��Ca(OH)2�ɵõ�Ca(ClO)2�����ɵõ�������������ȷ��
����ˮ����Ư���ԣ�pH��ֽ���ȱ���Ư�ף����ܲⶨ��ˮ��pH���ڴ���
�۵ⵥ������ۻ��������ʳ�������ӵ���KIO3�������۲������ɫ����˲�������������ʳ���еĵ�Ԫ�أ��۴���
��pH<5.6����ˮ�����꣬�ܴ���
�������Һ�к���SO32��������ϡ�����NO3�������������£��ὫSO32��������SO42����������BaSO4��ɫ�������ò������ܼ����SO42-���ݴ���
��SO2���������������ˮ����H2SO3����ʹ��ɫʯ����Һ��죬������ʹ֮��ɫ������
��NaOH��������ˮ����ȣ����û����ȴ��ת��������ƿ��ʵ���������ȴ������ʱ�������С����ҺŨ��ƫ����ȷ��
�����������ȷֽ�õ�����K2MnO4��MnO2��MnO2������ϡ���ᣬ��������ϴ�ӣ������
��AlCl3����Һ��ˮ��õ�Al(OH)3��HCl������ʹHCl�ӷ�����ٽ�ˮ��������У�ֱ��ˮ����ȫ���õ���Al(OH)3���ȷֽ����յõ�Al2O3�������
��H2O(1)����������H2O(g)�����������H2��O2��Ӧ����H2O(l)�ų����������࣬��H��С�������H1����H2������ȷ��
���Ϣڢۢܢݢޢ�����7����C�������⣻
��ѡC��

 �Ķ��쳵ϵ�д�
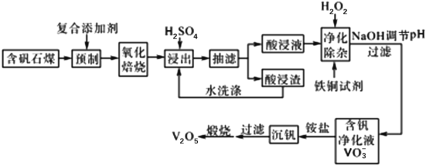
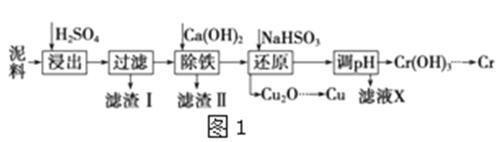
�Ķ��쳵ϵ�д�����Ŀ����ҵ�����õ�����ࣨ��Ҫ����Fe2O3��CuO��Cr2O3�������������ʣ�����ͭ���Ƚ���������������ͼ1��
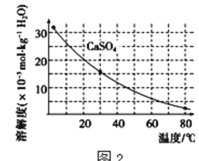
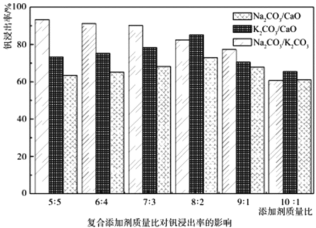
��֪�������ʳ�����pH��CaSO4���ܽ��������ͼ2��
Fe3+ | Cu2+ | Cr3+ | |
��ʼ����pH | 2.1 | 4.7 | 4.3 |
��ȫ����pH | 3.2 | 6.7 | a |
(1)�ڽ��������г�������Fe2(SO4)3��Cr2(SO4)3�⣬��Ҫ����__��
(2)�ڳ��������У���Ҫ��ȥFe3+��CaSO4���������ز�����������ʯ�������pH��Լ__������Fe3+�Ѿ������IJ�����__��������Һ�ӵ�80����__��
(3)д����ԭ�����м���NaHSO3����Cu2O���巴Ӧ�����ӷ���ʽ__���˲����м���NaHSO3�õ�Cu2O�IJ���Ϊ95%����NaHSO3�����������˷��Լ��⣬������ֵ�������__��
(4)��FeS������Һ�д��ڣ�FeS(s)![]() Fe2+(aq)+S2-(aq)��������FeS��Ksp=6.25��10-18����֪FeS������Һ��c(H+)��c(S2-)֮���������������ϵ��c2(H+)c(S2-)=1.0��10-22��Ϊ��ʹ��Һ��c(Fe2+)�ﵽ1molL-1���ֽ�����FeSͶ���䱥����Һ�У�Ӧ������Һ�е�c(H+)Ϊ___��
Fe2+(aq)+S2-(aq)��������FeS��Ksp=6.25��10-18����֪FeS������Һ��c(H+)��c(S2-)֮���������������ϵ��c2(H+)c(S2-)=1.0��10-22��Ϊ��ʹ��Һ��c(Fe2+)�ﵽ1molL-1���ֽ�����FeSͶ���䱥����Һ�У�Ӧ������Һ�е�c(H+)Ϊ___��
����Ŀ������ˮ��ɽ���ǽ�ɽ��ɽ��������о�NOx��SO2�ȴ�����Ⱦ������ƴ���������Ҫ���塣
(1)SO2���ŷ���Ҫ������ú��ȼ�գ���ҵ�ϳ��ð�ˮ���շ�����β���е�SO2����֪���չ�������ط�Ӧ���Ȼ�ѧ����ʽ���£�
��SO2(g)+NH3��H2O(aq)==NH4HSO3(aq) ��H1=akJ��mol��1��
��NH3��H2O(aq)+NH4HSO3(aq)==(NH4)2SO3(ag)+H2O(l) ��H2=bkJ��mol��1��
��2(NH4)2SO3(aq)+O2(g)==2(NH4)2SO4(aq) ��H3=ckJ��mol��1��
��Ӧ2SO2(g)+4NH3��H2O(aq)+O2(g)==2(NH4)2SO4(aq)+2H2O(1)�ġ�H=___________kJ��mol��1��
(2)ȼú���糧�����÷�Ӧ2CaCO3(s)+2SO2(g)+O2(g)===2CaSO4(s)+2CO2(g)
��H=��681.8kJ��mol��1��ú����������������SO2���ŷš����ڸ÷�Ӧ����T��ʱ��������������÷�Ӧ�ڲ�ͬʱ����ϸ����ʵ�Ũ�����£�
0 | 10 | 20 | 30 | 40 | 50 | |
O2 | 1.00 | 0.79 | 0.60 | 0.60 | 0.64 | 0.64 |
CO2 | 0 | 0.42 | 0.80 | 0.80 | 0.88 | 0.88 |
��0~10min�ڣ�ƽ����Ӧ����v(O2)___________mol��L��1��min��1���������¶ȣ��÷�Ӧ��ƽ�ⳣ��K___________(��������������С������������)��
��30min��ֻ�ı�ijһ��������Ӧ���´ﵽƽ�⡣�����ϱ��е������жϣ��ı������������___________(����ĸ)��
A����һ�����ķ�״̼��� Bͨ��һ������O2
C�ʵ���С��������� D������ʵĴ���
(3) NOx���ŷ���Ҫ����������β���������÷�Ӧ
C(s)+2NO(g)![]() N2(g)+CO2(g) ��H=��34.0kJ��mol��1���û���̿��NO������������֪���ܱ������м���������C��һ������NO���壬���ֺ�ѹ���NO��ת�������¶ȵı仯��ͼ��ʾ��
N2(g)+CO2(g) ��H=��34.0kJ��mol��1���û���̿��NO������������֪���ܱ������м���������C��һ������NO���壬���ֺ�ѹ���NO��ת�������¶ȵı仯��ͼ��ʾ��

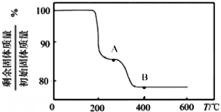
��ͼ��֪��1050Kǰ��Ӧ��NO��ת�������¶����{��������ԭ��Ϊ____________________����1100Kʱ��CO2���������Ϊ___________��
(4)��ij���ʵ�ƽ���ѹ���������ʵ���Ũ��Ҳ���Ա�ʾ��ѧƽ�ⳣ��(����Kp)����1050K��1.1��106Paʱ���÷�Ӧ�Ļ�ѧƽ�ⳣ��Kp=___________[��֪�������ѹ(P��)=������ѹ(Pa)���������]��
(5)Ϊ��������β���е��к�����Դ�������Ⱦ�����������װβ������װ�á��ھ���װ����CO��NO������Ӧ2NO(g)+2CO(g)![]() N2(g)+2CO2(g) ��H=��746.8k��mol��1����������N2��CO2��ʵ���ã�v��=k����c2(NO)��c2(CO)��v��=k����c(N2) ��c2(CO2)(k����k��Ϊ���ʳ�����ֻ���¶��й�)��
N2(g)+2CO2(g) ��H=��746.8k��mol��1����������N2��CO2��ʵ���ã�v��=k����c2(NO)��c2(CO)��v��=k����c(N2) ��c2(CO2)(k����k��Ϊ���ʳ�����ֻ���¶��й�)��
�ٴﵽƽ��������¶ȣ�k������ı���___________(����>����<������=��)k������ı�����
������1L���ܱ������г���1 molCO��1 molNO����һ���¶��´ﵽƽ��ʱ��CO��ת����Ϊ40%����![]() =___________��
=___________��