题目内容
3.下列分子或离子中,中心原子价层电子对互斥模型为四面体型,且分子或离子空间构型为V形的是( )| A. | NH4+ | B. | ClO3- | C. | H3O+ | D. | H2S |
分析 价层电子对几何构型为四面体说明该微粒的价层电子对是4,价层电子对=σ 键电子对+中心原子上的孤电子对;空间构型为V形说明该微粒中含有2个孤电子对,据此分析解答.
解答 解:A.NH4+中价层电子对个数=4+$\frac{1}{2}$(5-1-4×1)=4,且不含孤电子对,价层电子对几何构型和离子的空间构型均为正四面体形,故A错误;
B.ClO3-离子中价层电子对个数=σ键个数+孤电子对个数=3+$\frac{1}{2}$(7+1-3×2)=4,价层电子对互斥模型为四面体型,且含有一个孤电子对,所以离子空间构型为三角锥形,故B错误;
C.H3O+离子中价层电子对=3+1=4,所以其价层电子对几何构型为正四面体,该离子中含有一个孤电子对,所以其空间构型为三角锥型,故C错误;
D.H2S分子中S原子价层电子对=2+$\frac{1}{2}$(6-2)=4,价层电子对互斥模型为四面体型,且含有2个孤电子对,所以S原子采用sp3杂化,为V形结构,故D正确;
故选D.
点评 本题考查了微粒空间构型的判断,题目难度中等,先根据价层电子对判断VSEPR模型,去掉孤电子对就是其实际空间构型,这是高考的热点、学习的重点.

练习册系列答案
 期末复习检测系列答案
期末复习检测系列答案 超能学典单元期中期末专题冲刺100分系列答案
超能学典单元期中期末专题冲刺100分系列答案 黄冈360度定制密卷系列答案
黄冈360度定制密卷系列答案 阳光考场单元测试卷系列答案
阳光考场单元测试卷系列答案 名校联盟冲刺卷系列答案
名校联盟冲刺卷系列答案
相关题目
13.误食重金属盐会引起中毒,可用于急救解毒的方法有( )
| A. | 服用大量开水 | B. | 服用足量的牛奶 | ||
| C. | 服用足量的酒精 | D. | 服用足量的硫化钠 |
14.某化学兴趣小组的同学为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
试根据表中的实验现象回答下列问题:
(1)实验1和2中Al所作的电极(正极或负极)不相同(填“相同”或“不相同”).
(2)实验3中负极反应式:Al-3e-=Al3+;总反应的离子方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极,电极反应式:Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计指针偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
| 编号 | 电极材料 | 电解质溶液 | 电流计指针偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1和2中Al所作的电极(正极或负极)不相同(填“相同”或“不相同”).
(2)实验3中负极反应式:Al-3e-=Al3+;总反应的离子方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极,电极反应式:Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计指针偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
11.元素的化学性质主要决定于( )
| A. | 核外电子数 | B. | 核内质子数 | C. | 核内中子数 | D. | 最外层电子数 |
18.下列说法正确的是( )
| A. | 将AgNO3溶液滴入氨水中制银氨溶液 | |
| B. | 苯酚与苯甲醇(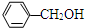 )分子组成相差一个-CH2原子团,因而它们互为同系物 )分子组成相差一个-CH2原子团,因而它们互为同系物 | |
| C. | 在酸性条件下,CH3CO18OC2H5的水解产物是CH3CO18OH和C2H5OH | |
| D. | 苯酚分子中由于羟基对苯环的影响,使苯环上的氢原子容易被取代 |
8.X元素的阳离子和Y元素的阴离子具有相同的电子层结构,下列叙述正确的是( )
| A. | 原子序数:X<Y | B. | 电负性:X<Y | C. | 离子半径:X>Y | D. | 原子半径:X<Y |
15.下列过程中不能引入卤素原子的是( )
| A. | 在空气中燃烧 | B. | 取代反应 | C. | 加成反应 | D. | 水解反应 |
13.某化学兴趣小组的同学为了探究铝电极在电池中的作用,设计并进行了以下一系列实验,实验结果记录如下:
试根据表中的实验现象回答下列问题:
(1)实验1和2中Al所作的电极(正极或负极)不相同(填“相同”或“不相同”).
(2)对实验3完成下列填空:
①铝为负极,电极反应式:2Al-6e-═2Al3+.
②石墨为正极,电极反应式:6H++6e-═3H2↑.
③电池总反应方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极,理由是Al失去电子.写出铝电极的电极反应式:Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计指针偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:自发的氧化还原反应中金属铝是否参与反应,金属铝参加反应,失电子作负极,反之作正极.
| 编号 | 电极材料 | 电解质溶液 | 电流计指针 偏转方向 |
| 1 | Mg、Al | 稀盐酸 | 偏向Al |
| 2 | Al、Cu | 稀盐酸 | 偏向Cu |
| 3 | Al、C(石墨) | 稀盐酸 | 偏向石墨 |
| 4 | Mg、Al | 氢氧化钠溶液 | 偏向Mg |
| 5 | Al、Zn | 浓硝酸 | 偏向Al |
(1)实验1和2中Al所作的电极(正极或负极)不相同(填“相同”或“不相同”).
(2)对实验3完成下列填空:
①铝为负极,电极反应式:2Al-6e-═2Al3+.
②石墨为正极,电极反应式:6H++6e-═3H2↑.
③电池总反应方程式:2Al+6H+═2Al3++3H2↑.
(3)实验4中铝作负极,理由是Al失去电子.写出铝电极的电极反应式:Al-3e-+4OH-═AlO2-+2H2O.
(4)解释实验5中电流计指针偏向铝的原因Al遇浓硝酸发生钝化,发生Zn与浓硝酸的氧化还原反应,Zn作负极,Al作正极,电流由正极流向负极,所以电流计指针偏向铝.
(5)根据实验结果总结出影响铝在原电池中作正极或负极的因素:自发的氧化还原反应中金属铝是否参与反应,金属铝参加反应,失电子作负极,反之作正极.