题目内容
16.(1)写出氯化亚铁溶液中通入氯气的离子方程式Cl2+2Fe2+=2Cl-+2Fe3+.(2)写出乙醇与氧气反应生成乙醛的化学方程式2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O.
分析 (1)氯化亚铁溶液中通入氯气,发生氧化还原反应生成氯化铁;
(2)乙醇催化氧化生成乙醛和水.
解答 解:(1)氯气与亚铁离子反应生成铁离子和氯离子,反应的离子方程式为:Cl2+2Fe2+=2Cl-+2Fe3+,
故答案为:Cl2+2Fe2+=2Cl-+2Fe3+;
(2)乙醇在催化剂存在条件下与氧气反应生成乙醛的化学方程式为:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O,
故答案为:2CH3CH2OH+O2$→_{△}^{催化剂}$2CH3CHO+2H2O;
点评 本题考查了离子方程式、化学方程式的书写,明确反应实质,乙醇的结构是解题关键,题目难度不大.

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
6.下列根据实验操作、实验现象所得出的结论不正确的是( )
| 选项 | 实验操作 | 实验现象 | 结论 |
| A | 用玻璃棒蘸取浓氨水点到红色石蕊试纸上 | 试纸变蓝色 | 浓氨水呈碱性 |
| B | 其他条件不变,压缩2HI(g)?I2(g)+H2(g)平衡体系的体积 | 混合气体颜色变深 | 平衡向生成I2(g)的方向移动 |
| C | 将碱式滴定管下部的胶管弯曲使玻璃尖嘴斜向上,用两指捏住胶管,轻轻挤压玻璃珠 | 使溶液从尖嘴流出 | 排出碱式滴定管尖嘴部分的气泡 |
| D | 向2.0mL浓度均为0.1mol•L-1的KCl、KI混合溶液中滴加1-2滴0.01mol•L-1AgNO3溶液,振荡 | 沉淀呈黄色 | KSP(AgCl)>KSP(AgI) |
| A. | A | B. | B | C. | C | D. | D |
4.化学无处不在,下列与化学有关的说法不正确的是( )
| A. | 侯氏制碱法的工艺过程中应用了物质溶解度的差异 | |
| B. | 可用蘸浓硫酸的棉棒检验输送氨气的管道是否漏气 | |
| C. | 碘是人体必需微量元素,所以要适量吃富含碘酸根原子团的食物 | |
| D. | 黑火药由硫黄、硝石、木炭三种物质按一定比例混合制成 |
11.下列实验操作或装置正确的是( )
| A. | 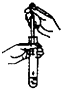 向试管中滴加液体 | B. | 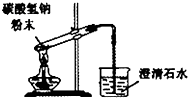 碳酸氢钠受热分解 | ||
| C. | 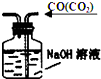 除去CO气体中的CO2气体 | D. | 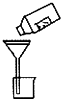 过滤 |
1.瑞典皇家科学院2001年10月10日宣布,2001年诺贝尔化学奖授予“手性催化氢化、氧化反应”研究领域作出贡献的美、日三位科学家.在有机物中,若碳原子上连接的四个原子和原子团不相同,则这个碳原子称为手性碳原子.有手性碳原子的物质具有光学活性.下列分子不具有光学活性是( )
| A. | 甘氨酸 | B. | 丙氨酸 | C. | 苯丙氨酸 | D. | 葡萄糖 |
8.已知 W、X、Y、Z为短周期主族元素,W、Z同主族,X、Y、Z同周期,W的气态氢化物的稳定性大于Z的气态氢化物的稳定性,X、Y为金属元素,X的阳离子的氧化性小于Y的阳离子的氧化性.下列说法正确的是( )
| A. | X、Y、Z、W的原子半径依次减小 | |
| B. | W与X形成的化合物中只可能含有离子键 | |
| C. | 在工业上X、Y都可以直接用加热分解的方法冶炼 | |
| D. | 若W与Y的原子序数相差5,则二者形成的化合物的化学式一定为Y2W3 |
6.下列反应,能用离子方程式S2-+2H+→H2S↑来表示的是( )
| A. | FeS+HCl | B. | K2S+HCl | C. | Na2S+CH3COOH | D. | K2S+H2SO3 |

 C
C ;
; ;该反应类型为消去反应.
;该反应类型为消去反应.