题目内容
(18分) 三个课外实验小组用Na2SO3溶液、FeCl3溶液及其它试剂做了一系列实验:
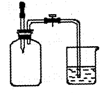
第一组:烧瓶中盛装滴有酚酞的 Na2SO3溶液,并放置在盛有水的烧杯中,然后向烧杯中加入浓硫酸,实验过程中发现烧瓶中溶液红色_____(填“变深”、“变浅”或“不变”),下列有关叙述正确的是_________(填字母)。
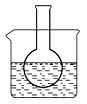
第二组:该小组讨论Fe3+和SO32-之间发生怎样的反应,提出了三种假设:①是发生氧化还原反应:2Fe3++SO32-+ H2O = 2Fe2++ SO42-+ 2H+;②是发生双水解反应:2Fe3++ 3SO32-+ 6H2O = 2Fe(OH)3(胶体) + 3H2SO3;③是两种反应同时发生。为了验证假设,同学们进行了下列实验,请填写下列空白:
(1)用试管取适量Na2SO3溶液,加入BaCl2稀溶液,有白色沉淀生成,再加稀盐酸,沉淀全部溶解,然后再进行后续实验。该实验操作的目的是______________________。
(2)取5 mL FeCl3溶液于试管中,逐滴加入Na2SO3溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3溶液至过量,溶液颜色最终变为红褐色。这种红褐色液体是__________________。向红褐色液体中加足量盐酸,将所得溶液分成两份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为________________________;另一份加入BaCl2稀溶液,产生少量白色沉淀,白色沉淀为________(填化学式)。
(3)由上述实验现象说明假设__________(填编号)是正确的。
第三组:用0.1000mol/L的酸性KMnO4溶液滴定未知浓度的Na2SO3溶液,用碱式滴定管量取25.00mL Na2SO3溶液于锥形瓶,用_____式滴定管盛装KMnO4溶液进行滴定,滴定终点颜色变化为:_____色变为_____色;重复三次实验,测得消耗的KMnO4溶液体积平均值为20.00mL,则Na2SO3的浓度为____________mol/L。
第一组:烧瓶中盛装滴有酚酞的 Na2SO3溶液,并放置在盛有水的烧杯中,然后向烧杯中加入浓硫酸,实验过程中发现烧瓶中溶液红色_____(填“变深”、“变浅”或“不变”),下列有关叙述正确的是_________(填字母)。

| A.溶液显浅红色是因为Na2SO3水解呈酸性 | B.水解反应为放热反应 |
| C.水解反应为吸热反应 | D.升高温度,Na2SO3水解程度增大 |
(1)用试管取适量Na2SO3溶液,加入BaCl2稀溶液,有白色沉淀生成,再加稀盐酸,沉淀全部溶解,然后再进行后续实验。该实验操作的目的是______________________。
(2)取5 mL FeCl3溶液于试管中,逐滴加入Na2SO3溶液,观察到溶液颜色由黄色变为红棕色,无气泡产生,无沉淀生成,继续加入Na2SO3溶液至过量,溶液颜色最终变为红褐色。这种红褐色液体是__________________。向红褐色液体中加足量盐酸,将所得溶液分成两份,其中一份加入KSCN溶液,溶液变成血红色,反应的离子方程式为________________________;另一份加入BaCl2稀溶液,产生少量白色沉淀,白色沉淀为________(填化学式)。
(3)由上述实验现象说明假设__________(填编号)是正确的。
第三组:用0.1000mol/L的酸性KMnO4溶液滴定未知浓度的Na2SO3溶液,用碱式滴定管量取25.00mL Na2SO3溶液于锥形瓶,用_____式滴定管盛装KMnO4溶液进行滴定,滴定终点颜色变化为:_____色变为_____色;重复三次实验,测得消耗的KMnO4溶液体积平均值为20.00mL,则Na2SO3的浓度为____________mol/L。
(共18分)
第一组: 变深 (1分)
C D (2分)
第二组:(1)检验Na2SO3溶液是否变质 (2分)
(2)Fe(OH)3胶体 (1分)
Fe3+ + 3SCN-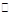 Fe(SCN)3 (2分)
Fe(SCN)3 (2分)
BaSO4 (2分)
(3)③ (2分)
第三组:酸 (1分)
无色变为紫(红)色 (2分)
0.2000 mol/L (3分)
第一组: 变深 (1分)
C D (2分)
第二组:(1)检验Na2SO3溶液是否变质 (2分)
(2)Fe(OH)3胶体 (1分)
Fe3+ + 3SCN-
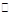 Fe(SCN)3 (2分)
Fe(SCN)3 (2分)BaSO4 (2分)
(3)③ (2分)
第三组:酸 (1分)
无色变为紫(红)色 (2分)
0.2000 mol/L (3分)
第一组:盐类的水解为吸热反应:SO32-+H2O HSO3-+OH-;浓硫酸与水混合放出大量的热,促进了Na2SO3的水解,溶液碱性增强,红色加深:
HSO3-+OH-;浓硫酸与水混合放出大量的热,促进了Na2SO3的水解,溶液碱性增强,红色加深:
第二组:(1)Na2SO3易被氧化为Na2SO4,必须先检验其是否变质,否则将影响下面的SO42-的检测
(2)Fe(OH)3(胶体)为红褐色;
铁离子与SCN—可生成络合物呈血红色:Fe3+ + 3SCN- Fe(SCN)3
Fe(SCN)3
不溶于酸的白色沉淀,一定为BaSO4;
(3)综合上面的实验事实可知,两物质同进发生了两种反应,故选③
第三组:KMnO4溶液具有强氧化性,可腐蚀橡胶管,故只能用酸式滴定管最取;
KMnO4溶液本身具有紫色,当滴下一滴液体,紫色不褪去,并且半分钟不褪,则视为滴定终点;
由反应:2MnO4—~5SO32—可知,KMnO4的物质的量为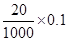 mol=0.002mol,SO32—的物质的量为0.005mol,Na2SO3的浓度为
mol=0.002mol,SO32—的物质的量为0.005mol,Na2SO3的浓度为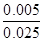 =0.2000 mol/L
=0.2000 mol/L
 HSO3-+OH-;浓硫酸与水混合放出大量的热,促进了Na2SO3的水解,溶液碱性增强,红色加深:
HSO3-+OH-;浓硫酸与水混合放出大量的热,促进了Na2SO3的水解,溶液碱性增强,红色加深:第二组:(1)Na2SO3易被氧化为Na2SO4,必须先检验其是否变质,否则将影响下面的SO42-的检测
(2)Fe(OH)3(胶体)为红褐色;
铁离子与SCN—可生成络合物呈血红色:Fe3+ + 3SCN-
 Fe(SCN)3
Fe(SCN)3 不溶于酸的白色沉淀,一定为BaSO4;
(3)综合上面的实验事实可知,两物质同进发生了两种反应,故选③
第三组:KMnO4溶液具有强氧化性,可腐蚀橡胶管,故只能用酸式滴定管最取;
KMnO4溶液本身具有紫色,当滴下一滴液体,紫色不褪去,并且半分钟不褪,则视为滴定终点;
由反应:2MnO4—~5SO32—可知,KMnO4的物质的量为
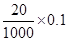 mol=0.002mol,SO32—的物质的量为0.005mol,Na2SO3的浓度为
mol=0.002mol,SO32—的物质的量为0.005mol,Na2SO3的浓度为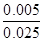 =0.2000 mol/L
=0.2000 mol/L
练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目

 后,立
后,立