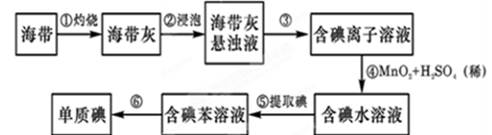
题目内容
下列实验操作正确的是 。
E.配制银氨溶液时,将稀氨水慢慢滴入硝酸银溶液中,产生沉淀后继续滴加到沉淀刚好溶解为止
F.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合加热,充分振荡溶液、静置、待液体冷却后,滴加硝酸银溶液
G.向甲苯中加入酸性高锰酸钾溶液振荡,紫色不能退去
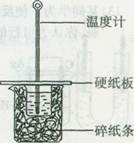
| A.用量热计测定中和热时,为了操作方便,可用温度计直接搅拌 |
B.将铜丝弯成螺旋状,在酒精灯上加热变黑 后,立 后,立 即伸入盛有无水乙醇的试管中,重复几次,完成乙醇氧化为乙醛的实验 即伸入盛有无水乙醇的试管中,重复几次,完成乙醇氧化为乙醛的实验 |
| C.试管中先加入一定量浓硫酸,再依次加入适量冰醋酸、无水乙醇,再加热制取乙酸乙酯 |
D.实验室制取乙烯时, 放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动 放入几片碎瓷片,以避免混合液在受热沸腾时剧烈跳动 |
F.验证溴乙烷水解产物时,将溴乙烷和氢氧化钠溶液混合加热,充分振荡溶液、静置、待液体冷却后,滴加硝酸银溶液
G.向甲苯中加入酸性高锰酸钾溶液振荡,紫色不能退去
BDE (3分)
略

练习册系列答案
相关题目