题目内容
【题目】
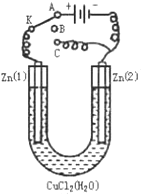
(1)如果把开关K接A,该装置应是 ,Zn(2)极是 极,电极反应式为 。
(2)上述反应进行5min后,置换开关K到C,则该装置是 ,Zn(2)极是 极,电极反应式是 。
(3)上述装置进行2min后,再置换开关K至B,则Zn(1)极发生的化学反应方程式为 ,Zn(2)极发生的有关电化学的反应方程式为 。
【答案】(1)电解池阳Zn―2e―=Zn2+(2)原电池正Cu2++2e-==Cu
(3)Zn+CuCl2===Cu+ZnCl2负:Zn―2e―==Zn2+正:Cu2++2e-==Cu
【解析】试题分析:(1)如果把开关K接A,就和电源的正极相连,该装置应是电解池,Zn(2)极是阴极,电极反应式:Cu2++2e-=Cu
(2)上述反应进行5min后,置换开关K到C,则该装置是原电池,Zn(2)极是正极,电极反应式是:Cu2++2e-=Cu
(3)再置换开关K至B,没有形成闭合回路,Zn(1)极和氯化铜溶液发生置换反应,反应方程式为:Zn+CuCl2=Cu+ZnCl2,Zn(2)极上有铜附着,自身形成原电池,电极反应是负:Zn―2e―=Zn2+正:Cu2++2e-=Cu。

【题目】原电池是化学对人类的一项重大贡献。
(1)某兴趣小组为研究原电池原理,设计如图A装置。
|
|
A | B |
①a和b不连接时,烧杯中发生反应的离子方程式是 _________________________。
②a和b用导线连接,Cu极为原电池________极(填“正”或“负”),该电极反应式是____________________。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.2 mol电子, 则理论上Zn片质量减轻________g。
(2)如图是甲烷燃料电池原理示意图B,回答下列问题:
①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为: _________________________。
②电池工作一段时间后电解质溶液的pH__________(填“增大”“减小”或“不变”)。
【题目】锌和铝都是活泼金属,它们的单质及化合物的性质具有一定的相似性。
(1)下图表示常温下二价锌在水溶液中的存在形式与pH的关系,横坐标为溶液的pH值,纵坐标为Zn2+离子或[Zn(OH)4]2-离子物质的量浓度的对数,回答下列问题:

①将单质Zn加入足量的氢氧化钠溶液中,反应的离子方程式可表示为:
___________________________________________________________________________
②从图中数据计算可得Zn(OH)2的溶度积(Ksp)= _________________________。
③往1L1.00 mol·L-1ZnCl2溶液中加入NaOH固体至pH=6,需NaOH ____ mol。
④已知:往ZnCl2溶液中加入硝酸铅或醋酸铅溶液可以制得PbCl2白色晶体;25℃时,PbCl2固体在盐酸中的溶解度如下:
c(HCl)/( mol·L-1) | 0.50 | 1.00 | 2.04 | 2.90 | 4.02 | 5.16 | 5.78 |
c(PbCl2)/( mol·L-1)×10-3 | 5.10 | 4.91 | 5.21 | 5.90 | 7.48 | 10.81 | 14.01 |
根据上表数据判断下列说法正确的是____________。
A.随着盐酸浓度的增大,PbCl2固体的溶解度变小
B.PbCl2固体在0.50 mol·L-1盐酸中的Ksp小于在纯水中的Ksp
C.PbCl2能与浓盐酸反应生成一种难电离的阴离子(络合离子)
D.PbCl2固体可溶于饱和食盐水
(2)氢氧化锌与氢氧化铝的性质又存在一定的差异,如氢氧化铝不溶于氨水,而氢氧化锌能溶于氨水,生成配合物离子[Zn(NH3)4]2+。
①在25℃下,将a molL—1的NH4Cl溶液与0.01molL—1的NaOH溶液等体积混合,反应后测得溶液pH=7,用含a的代数式表示NH4+的水解常数Kh=___________mol L—1。
②若25℃时将浓度均为0.1molL—1的NH4Cl、NH3·H2O溶液等体积混合后,溶液呈碱性,则关于该溶液的说法不正确的是____________(填字母)。
a.此溶液一定有c(NH4+)+ c ( H+) = c(OH—) +c ( Cl—)
b.此溶液一定有c(Cl-) = c (NH3·H2O) +c(NH4+)
c.混合溶液中水的电离程度一定大于该温度下纯水的电离程度
d.此溶液加入少量氢氧化钠或盐酸,溶液的pH变化不大