题目内容
【题目】原电池是化学对人类的一项重大贡献。
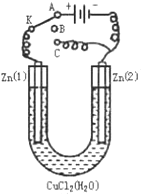
(1)某兴趣小组为研究原电池原理,设计如图A装置。
|
|
A | B |
①a和b不连接时,烧杯中发生反应的离子方程式是 _________________________。
②a和b用导线连接,Cu极为原电池________极(填“正”或“负”),该电极反应式是____________________。
③无论a和b是否连接,Zn片均被腐蚀,若转移了0.2 mol电子, 则理论上Zn片质量减轻________g。
(2)如图是甲烷燃料电池原理示意图B,回答下列问题:
①电池的负极是________(填“a”或“b”)电极,该极的电极反应式为: _________________________。
②电池工作一段时间后电解质溶液的pH__________(填“增大”“减小”或“不变”)。
【答案】 Zn+2H+===Zn2++H2↑ 正 2H++2e-===H2↑ 6.5 a CH4+10OH--8e-===CO32-+7H2O 减小
【解析】试题分析:(1)①a和b不连接时,不能构成原电池;②a和b用导线连接构成原电池,锌比铜活泼,Cu为正极、锌为负极;③根据![]() 分析;(2)①电池的负极失电子发生氧化反应,正极得电子发生还原反应; ②根据电池总反应分析电池工作一段时间后电解质溶液的pH;
分析;(2)①电池的负极失电子发生氧化反应,正极得电子发生还原反应; ②根据电池总反应分析电池工作一段时间后电解质溶液的pH;
解析:(1)①a和b不连接时,不能构成原电池,锌与硫酸发生反应生成硫酸锌和氢气,离子方程式是Zn+2H+===Zn2++H2↑;②a和b用导线连接构成原电池,锌比铜活泼,Cu为正极、锌为负极,正极电极反应式是2H++2e-===H2↑,负极反应式为![]() ;③根据
;③根据![]() ,转移了0.2 mol电子,消耗0.1molZn,质量为0.1mol×65g/mol=6.5g;(2)①负极失电子发生氧化反应,正极得电子发生还原反应,a极通入甲烷,甲烷发生氧化反应,故a是负极,负极电极反应为CH4+10OH--8e-===CO32-+7H2O; ②电池总反应为CH4+2O2+2OH-===CO32-+3H2O,,电池工作时消耗氢氧根离子,电解质溶液的pH减小。
,转移了0.2 mol电子,消耗0.1molZn,质量为0.1mol×65g/mol=6.5g;(2)①负极失电子发生氧化反应,正极得电子发生还原反应,a极通入甲烷,甲烷发生氧化反应,故a是负极,负极电极反应为CH4+10OH--8e-===CO32-+7H2O; ②电池总反应为CH4+2O2+2OH-===CO32-+3H2O,,电池工作时消耗氢氧根离子,电解质溶液的pH减小。