题目内容
有A、B、C、D四种元素,其中A、B、C属于同一周期,A原子最外层p能级的电子数等于次外层的电子总数;B原子最外层中有三个不成对的电子;C元素可分别与A、B、D生成RC2型化合物,其中的DC2与C3互为等电子体。下列叙述中不正确的是
A.D原子的简化电子排布式为[Ar]3s23p4
B.B、C两元素的第一电离能大小关系为B>C
C.用电子式表示AD2的形成过程为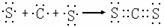
D.由B60分子形成的晶体与A60相似,分子中总键能:B60 >A60
【答案】
A
【解析】
试题分析:A项:D为S元素,原子序数为16,基态原子的核外电子排布式为1s22s22p63s23p4,简化电子排布式为[Ne]3s23p4,故错。故选A。
考点:原子结构与元素周期率的关系 原子核外电子排布 元素电离能的含义及应用 共价键的形成及共价键的主要类型
点评:本题考查较为综合,涉及元素的推断、电子排布式的书写、电子式、第一电离能、杂化类型以及元素周期律等知识,题目难度中等,本题中正确推断元素的种类为解答该题的关键。

练习册系列答案
相关题目




