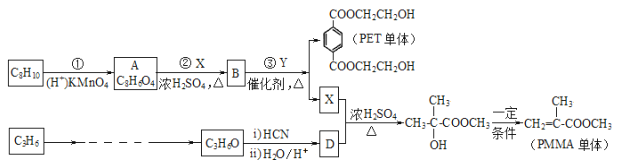
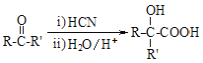题目内容
【题目】常温下,在溶液中可发生以下反应:
①2Fe2++Br2![]() 2Fe3++2Br-,②2Br-+Cl2
2Fe3++2Br-,②2Br-+Cl2![]() Br2+2Cl-,③2Fe3++2I-
Br2+2Cl-,③2Fe3++2I-![]() 2Fe2++I2。
2Fe2++I2。
由此判断下列说法错误的是
A. 氧化性强弱顺序为:Cl2>Br2>Fe3+>I2
B. 反应②中当有1 mol Cl2被还原时,有2mol Br-被氧化
C. 铁元素在反应①和③中均被氧化
D. 还原性强弱顺序为:I->Fe2+>Br->Cl-
【答案】C
【解析】
A.反应2Fe2++Br2=2Fe3++2Br-中Fe2+被单质溴氧化为Fe3+,反应2Br-+Cl2=Br2+2Cl-中溴离子被氯气氧化为单质溴,反应2Fe3++2I-=2Fe2++I2中I-被Fe3+氧化为I2,根据氧化剂的氧化性强于氧化产物的氧化性可知氧化性强弱顺序为Cl2>Br2>Fe3+>I2,A正确;
B.反应2Br-+Cl2=Br2+2Cl-中,当有1 mol Cl2被还原时,有2 mol Br-被氧化,B正确;
C.反应①中铁元素被氧化,反应③中铁元素被还原,C错误;
D、根据还原剂的还原性强于还原产物的还原性可知还原性强弱顺序为:I->Fe2+>Br->Cl-,D正确;
答案选C。

【题目】用活性炭还原处理氮氧化物,有关反应为C(s)+2NO(g) ![]() N2(g)+CO2(g)。
N2(g)+CO2(g)。
(1)写出上述反应的平衡常数表达式_______________。
(2)在2L恒容密闭器中加入足量C与NO发生反应,所得数据如表,回答下列问题。
实验编号 | 温度/℃ | 起始时NO的物质的量/mol | 平衡时N2的物质的量/mol |
1 | 700 | 0.40 | 0.09 |
2 | 800 | 0.24 | 0.08 |
①结合表中数据,判断该反应的△H____0(填“>”或“<”),理由是_________。
②判断该反应达到平衡的依据是_______。
A.容器内气体密度恒定 B.容器内各气体浓度恒定
C.容器内压强恒定 D.2v正(NO)= v逆(N2)
(3)700℃时,若向2L体积恒定的密闭容器中充入一定量N2和CO2发生反应:N2(g)+CO2(g)![]() C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
C(s)+2NO(g) ;其中N2、NO物质的量随时间变化的曲线如下图所示。请回答下列问题。
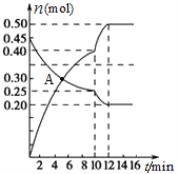
①0~10 min内的CO2平均反应速率v=____________。
②图中A点v(正)___v(逆)(填“>”、“<”或“=”)。
③第10 min时,外界改变的条件可能是_____________。
A.加催化剂 B.增大C的物质的量
C.减小CO2的物质的量 D.升温 E.降温