题目内容
【题目】下列离子方程式正确的是( )
A. 向溴化亚铁溶液中通入少量氯气:2Fe2++Cl2===2Fe3++2Cl-
B. 苯酚钠溶液中通入少量CO2:2C6H5O-+CO2+H2O―→2C6H5OH+CO![]()
C. 向硫酸氢钠溶液中滴入氢氧化钡溶液至中性:H++SO![]() +Ba2++OH-===BaSO4↓+H2O
+Ba2++OH-===BaSO4↓+H2O
D. 将氢氧化铁粉末加入氢碘酸中:Fe(OH)3+3H+===Fe3++3H2O
【答案】A
【解析】
还原性Fe2+>Br-,向溴化亚铁溶液中通入少量氯气:2Fe2++Cl2===2Fe3++2Cl-,故A正确;苯酚钠溶液中通入少量CO2: C6H5O-+CO2+H2O―→C6H5OH+HCO3-,故B错误;
向硫酸氢钠溶液中滴入氢氧化钡溶液至中性:2H++SO![]() +Ba2++2OH-===BaSO4↓+2H2O,故C错误;将氢氧化铁粉末加入氢碘酸中:2Fe(OH)3+6H++2I-===2Fe2++6H2O+I2,故D错误。
+Ba2++2OH-===BaSO4↓+2H2O,故C错误;将氢氧化铁粉末加入氢碘酸中:2Fe(OH)3+6H++2I-===2Fe2++6H2O+I2,故D错误。

【题目】已知常温下浓度为0.1mol/L的几种溶液的pH如下表。下列有关说法不正确的是
溶质 | NaF | Na2CO3 | NaClO | NaHCO3 |
pH | 7.5 | 11.6 | 9.7 | 8.3 |
A. 同温度同浓度下,酸性由强到弱的顺序为:HF>H2CO3>HClO
B. 水解方程式:F-+H2O![]() HF+OH-的平衡常数约为9×10-13
HF+OH-的平衡常数约为9×10-13
C. 将CO2通入0.lmol/LNa2CO3溶液至溶液呈中性,则溶液中:c(CO32-)+c(HCO3-)+ c(H2CO3)=0.2mol/L
D. 等物质的量的NaF和HF混合溶液中粒子浓度大小关系为:c(F-)>c(Na+)> >c (H+)>c(OH-)
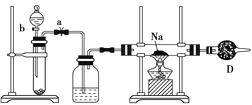
【题目】下列实验操作对应的现象符合事实的是( )
|
|
|
|
A.将绿豆大小的金属钠投入蒸馏水中,钠块熔成小球,浮于水面,迅速游 动,溶液变红 | B.将甲烷与氯气1∶1混合,在光照条件下反应,黄绿色褪去,水面上升,充满集气瓶 | C.将5g碳酸钙投入20mL1mol·L-1盐酸,针筒活塞向右移动的速率先逐渐增大,然后减小 | D.将铜片与浓硫酸混合加热,品红溶液变红,试管内出现蓝色固体和 少量黑色物质 |
A.AB.BC.CD.D