题目内容
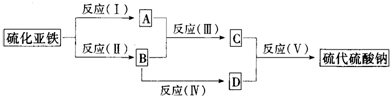
 A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.
A、B、C、D都是中学化学常见的物质,其中A、B、C均含有同一种元素.在一定条件下相互转化的关系如图所示.
请回答下列问题:
(1)若通常情况下A、B、C、D都是气体,且B和D为空气的主要成分,A和D反应生成B的化学方程式为______.B的结构式为______.
(2)若D为用量最大、用途最广的金属单质,加热蒸干B的溶液没有得到B的盐,继续灼烧后得到的固体物质成分是______.
(3)若D为氯碱工业的重要产品,反应(Ⅲ)的离子方程式为______.
(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,也可作为医疗上治疗胃酸过多症的药剂.
①C溶液呈碱性的原因是______.(用离子方程式表示)
②将等物质的量的B和C溶于水形成混合溶液,溶液中各种离子浓度由大到小的顺序为______.
解:(1)B和D为空气的主要成分,则为N2和O2,根据A→B→C的反应中都有D参加反应,则D应为O2,B为N2,转化关系为:NH3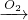 N2
N2 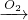 NO;则A为 NH3,发生反应的化学方程式为4NH3+3O2=2N2+6H2O; B为氮气结构式为N≡N,
NO;则A为 NH3,发生反应的化学方程式为4NH3+3O2=2N2+6H2O; B为氮气结构式为N≡N,
故答案为:4NH3+3O2=2N2+6H2O;N≡N;
(2)若D为用量最大、用途最广的金属单质为Fe,加热蒸干B的溶液没有得到B的盐,说明该盐对应的酸为挥发性酸,则B的化学式可能为FeCl3 或Fe(NO3)3,转化关系分别为:
Cl2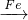 FeCl3
FeCl3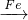 FeCl2;HNO3
FeCl2;HNO3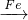 Fe(NO3)3
Fe(NO3)3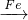 Fe(NO3)2;FeCl3 或Fe(NO3)3加热蒸干溶液得到Fe(OH)3;继续灼烧后得到的固体物质为Fe2O3,
Fe(NO3)2;FeCl3 或Fe(NO3)3加热蒸干溶液得到Fe(OH)3;继续灼烧后得到的固体物质为Fe2O3,
故答案为:Fe2O3;
(3)若D为氯碱工业的重要产品,应为NaOH,能与NaOH连续反应的物质,反应的转化关系为Al3+ Al(OH)3
Al(OH)3 AlO2-,则反应(Ⅲ)的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
AlO2-,则反应(Ⅲ)的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,也可作为医疗上治疗胃酸过多症的药剂,则C为NaHCO3;A、B、C的转化关系为:NaOH Na2CO3
Na2CO3 NaHCO3;
NaHCO3;
①碳酸氢钠溶液呈碱性的原因是碳酸氢根离子水解生成碳酸和氢氧化钠,离子方程式为:HCO3-+H2O?H2CO3+OH-,故答案为:HCO3-+H2O?H2CO3+OH-;
②将等物质的量的Na2CO3,NaHCO3溶于水形成混合溶液,由于CO32-离子水解生成HCO3-离子,故c(HCO3-)>c(CO32-),Na2CO3,NaHCO3水解呈碱性,故c(OH-)>c(H+),水解的程度只是少部分,故c(CO32-)>c(OH-),各种离子浓度由大到小的顺序为c(Na+ )>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+ )>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
分析:(1)B和D为空气的主要成分,则为N2和O2,根据A→B→C的反应中都有D参加反应,则D应为O2,B为N2,转化关系为:NH3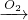 N2
N2 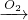 NO;则A为 NH3,根据变化书写化学方程式,以此书写电子式和结构式;
NO;则A为 NH3,根据变化书写化学方程式,以此书写电子式和结构式;
(2)若D为用量最大、用途最广的金属单质为Fe,加热蒸干B的溶液没有得到B的盐,说明该盐对应的酸为挥发性酸,则B的化学式可能为FeCl3 或Fe(NO3)3;
(3)若D为氯碱工业的重要产品,应为NaOH,能与NaOH连续反应的物质,反应的转化关系为Al3+ Al(OH)3
Al(OH)3 AlO2-,则反应(Ⅲ)的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓;
AlO2-,则反应(Ⅲ)的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓;
(4)①若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,也可作为医疗上治疗胃酸过多症的药剂,则C为NaHCO3,A、B、C的转化关系为:NaOH Na2CO3
Na2CO3 NaHCO3;②将等物质的量的Na2CO3,NaHCO3溶于水形成混合溶液,由于CO32-离子水解生成HCO3-离子,故c(HCO3-)>c(CO32-),Na2CO3,NaHCO3水解呈碱性,故c(OH-)>c(H+),水解的程度只是少部分,故c(CO32-)>c(OH-),以此判断离子浓度大小.
NaHCO3;②将等物质的量的Na2CO3,NaHCO3溶于水形成混合溶液,由于CO32-离子水解生成HCO3-离子,故c(HCO3-)>c(CO32-),Na2CO3,NaHCO3水解呈碱性,故c(OH-)>c(H+),水解的程度只是少部分,故c(CO32-)>c(OH-),以此判断离子浓度大小.
点评:本题考查较为综合,涉及元素化合物的推断、浓度的计算和离子浓度的大小比较等问题,题目具有一定难度,做题时注意把握推断的思路和盐类的水解规律.
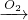 N2
N2 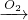 NO;则A为 NH3,发生反应的化学方程式为4NH3+3O2=2N2+6H2O; B为氮气结构式为N≡N,
NO;则A为 NH3,发生反应的化学方程式为4NH3+3O2=2N2+6H2O; B为氮气结构式为N≡N,故答案为:4NH3+3O2=2N2+6H2O;N≡N;
(2)若D为用量最大、用途最广的金属单质为Fe,加热蒸干B的溶液没有得到B的盐,说明该盐对应的酸为挥发性酸,则B的化学式可能为FeCl3 或Fe(NO3)3,转化关系分别为:
Cl2
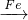 FeCl3
FeCl3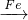 FeCl2;HNO3
FeCl2;HNO3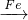 Fe(NO3)3
Fe(NO3)3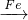 Fe(NO3)2;FeCl3 或Fe(NO3)3加热蒸干溶液得到Fe(OH)3;继续灼烧后得到的固体物质为Fe2O3,
Fe(NO3)2;FeCl3 或Fe(NO3)3加热蒸干溶液得到Fe(OH)3;继续灼烧后得到的固体物质为Fe2O3,故答案为:Fe2O3;
(3)若D为氯碱工业的重要产品,应为NaOH,能与NaOH连续反应的物质,反应的转化关系为Al3+
 Al(OH)3
Al(OH)3 AlO2-,则反应(Ⅲ)的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;
AlO2-,则反应(Ⅲ)的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓,故答案为:Al3++3AlO2-+6H2O=4Al(OH)3↓;(4)若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,也可作为医疗上治疗胃酸过多症的药剂,则C为NaHCO3;A、B、C的转化关系为:NaOH
 Na2CO3
Na2CO3 NaHCO3;
NaHCO3;①碳酸氢钠溶液呈碱性的原因是碳酸氢根离子水解生成碳酸和氢氧化钠,离子方程式为:HCO3-+H2O?H2CO3+OH-,故答案为:HCO3-+H2O?H2CO3+OH-;
②将等物质的量的Na2CO3,NaHCO3溶于水形成混合溶液,由于CO32-离子水解生成HCO3-离子,故c(HCO3-)>c(CO32-),Na2CO3,NaHCO3水解呈碱性,故c(OH-)>c(H+),水解的程度只是少部分,故c(CO32-)>c(OH-),各种离子浓度由大到小的顺序为c(Na+ )>c(HCO3-)>c(CO32-)>c(OH-)>c(H+),
故答案为:c(Na+ )>c(HCO3-)>c(CO32-)>c(OH-)>c(H+).
分析:(1)B和D为空气的主要成分,则为N2和O2,根据A→B→C的反应中都有D参加反应,则D应为O2,B为N2,转化关系为:NH3
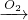 N2
N2 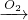 NO;则A为 NH3,根据变化书写化学方程式,以此书写电子式和结构式;
NO;则A为 NH3,根据变化书写化学方程式,以此书写电子式和结构式;(2)若D为用量最大、用途最广的金属单质为Fe,加热蒸干B的溶液没有得到B的盐,说明该盐对应的酸为挥发性酸,则B的化学式可能为FeCl3 或Fe(NO3)3;
(3)若D为氯碱工业的重要产品,应为NaOH,能与NaOH连续反应的物质,反应的转化关系为Al3+
 Al(OH)3
Al(OH)3 AlO2-,则反应(Ⅲ)的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓;
AlO2-,则反应(Ⅲ)的离子方程式为Al3++3AlO2-+6H2O=4Al(OH)3↓;(4)①若A、B、C的溶液均显碱性,C为焙制糕点的发酵粉的主要成分之一,也可作为医疗上治疗胃酸过多症的药剂,则C为NaHCO3,A、B、C的转化关系为:NaOH
 Na2CO3
Na2CO3 NaHCO3;②将等物质的量的Na2CO3,NaHCO3溶于水形成混合溶液,由于CO32-离子水解生成HCO3-离子,故c(HCO3-)>c(CO32-),Na2CO3,NaHCO3水解呈碱性,故c(OH-)>c(H+),水解的程度只是少部分,故c(CO32-)>c(OH-),以此判断离子浓度大小.
NaHCO3;②将等物质的量的Na2CO3,NaHCO3溶于水形成混合溶液,由于CO32-离子水解生成HCO3-离子,故c(HCO3-)>c(CO32-),Na2CO3,NaHCO3水解呈碱性,故c(OH-)>c(H+),水解的程度只是少部分,故c(CO32-)>c(OH-),以此判断离子浓度大小.点评:本题考查较为综合,涉及元素化合物的推断、浓度的计算和离子浓度的大小比较等问题,题目具有一定难度,做题时注意把握推断的思路和盐类的水解规律.

练习册系列答案
相关题目
 A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图所示(部分反应中的水已略去).
A、B、C、D都是中学化学中常见物质,其中A、B、C均含有同一种元素,在一定条件下相互转化关系如图所示(部分反应中的水已略去). Fe(OH)3+3H+
Fe(OH)3+3H+