题目内容
【题目】硝酸是一种重要的化工原料。以![]() 和
和![]() 为原料合成氨气
为原料合成氨气![]() 。取一定量的
。取一定量的![]() 和
和![]() 置于密闭容器中进行反应。已知化学平衡常数K与温度的关系如表:
置于密闭容器中进行反应。已知化学平衡常数K与温度的关系如表:
| 200 | 300 | 400 |
K |
|
|
|
(1)写出该反应的平衡常数表达式______。
(2)K1和![]() 比较:
比较:![]() ______
______![]() 填写“
填写“![]() ”、“
”、“![]() ”或“
”或“![]() ”
”![]()
(3)在![]() 时该反应进行一段时间后,测定
时该反应进行一段时间后,测定![]() 、
、![]() 和
和 ![]() 的物质的量分别为2mol、1mol和2mol,则此时反应速率
的物质的量分别为2mol、1mol和2mol,则此时反应速率![]() ______
______![]() 。
。 ![]() 填写“
填写“![]() ”、“
”、“![]() ”、“
”、“![]() ”或“不能确定”
”或“不能确定”![]()
【答案】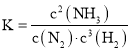
![]() 不能确定
不能确定
【解析】
(1)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比;
(2)该反应的正反应是放热反应,升高温度平衡逆向移动,化学平衡常数减小;
(3)容器体积未知,无法计算该时刻各物质浓度导致无法计算浓度商;
(1)化学平衡常数K等于生成物浓度幂之积与反应物浓度幂之积的比,则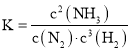 ,
,
故答案为: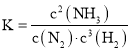 ;
;
(2)该反应的正反应是放热反应,升高温度平衡逆向移动,化学平衡常数减小,所以![]() ,
,
故答案为:![]() ;
;
(3)容器体积未知,无法计算该时刻各物质浓度导致无法计算浓度商,无法与化学平衡常数比较相对大小,所以无法判断反应方向,
故答案为:不能确定;

练习册系列答案
 名校课堂系列答案
名校课堂系列答案
相关题目
【题目】已知:Fe2+遇铁氰化钾(K3[Fe(CN)6])会产生特征的蓝色沉淀;AgI是难溶于水的黄色固体。将0.2mol·L-1的KI溶液和0.05mol·L-1Fe2(SO4)3溶液等体积混合后,取混合液分别完成上述实验,能说明溶液中存在化学平衡“2Fe3++2I-![]() 2Fe2++I2”的是( )
2Fe2++I2”的是( )
编号 | 实验操作 | 实验现象 |
① | 滴入KSCN溶液 | 溶液变红色 |
② | 滴入AgNO3溶液 | 生成黄色沉淀 |
③ | 滴入K3[Fe(CN)6]溶液 | 生成蓝色沉淀 |
④ | 滴入淀粉溶液 | 溶液变蓝色 |
A.①B.②和④C.③和④D.③