题目内容
17.黄铜矿是工业炼铜的主要原料,其主要成分为CuFeS2,现有一种天然黄铜矿(含少量SiO2),为了测定该黄铜矿的纯度,某同学设计了如图1实验: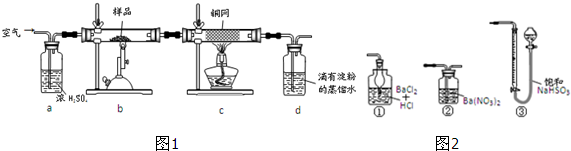
现称取研细的黄铜矿样品1.150g,在空气存在下进行煅烧,生成Cu、Fe3O4和SO2气体,实验后取d中溶液的$\frac{1}{10}$置于锥形瓶中,用0.05mol/L标准碘溶液进行滴定,消耗标准溶液20.00mL.(所得气体在d装置中全部被吸收)请回答下列问题:
(1)称量1.150g该黄铜矿样品所用的仪器为电子天平(填“托盘天平”或“电子天平”).
(2)装置a和c的作用分别是b和d(填标号).
A.除去SO2气体 B.除去空气中的水蒸气和有利于观察空气流速
C.有利于气体混合 D.除去反应后多余的氧气
(3)上述反应结束后,仍需通一段时间的空气,其目的是使反应生成的SO2全部进入d装置中,使结果精确.
(4)通过计算可知,该黄铜矿的纯度为80%.
(5)若用图2装置替代上述实验装置d,同样可以达到实验目的是②(填序号).
(6)若将原装置d中的试液改为Ba(OH)2,测得的黄铜矿纯度误差为+1%,假设实验操作均正确,可能的原因主要有空气中的CO2与Ba(OH)2反应生成BaCO3沉淀,BaSO3被氧化成BaSO4.(回答其中一个原因)
分析 该实验原理是:根据黄铜矿受热分解产生的二氧化硫的量的测定(二氧化硫可以用碘水来标定),结合元素守恒可以确定黄铜矿的量,进而计算其纯度.
(1)根据样品称量的精确度来分析;
(2)浓硫酸可以将水除去,还可以根据冒出气泡的速率来调节空气流速;灼热的铜网可以除去多余的氧气;
(3)二氧化硫全部被吸收是实验成败的关键;
(4)根据滴定管的读数方法和要求来回答判断;
(5)二氧化硫和单质碘之间发生氧化还原反应,根据消耗碘单质的量可以确定二氧化硫的量,进而确定黄铜矿的纯度;
(6)二氧化碳和二氧化硫均可以和氢氧化钡反应生成白色沉淀,亚硫酸钡易被氧化为硫酸钡.
解答 解:该实验原理是:根据黄铜矿受热分解产生的二氧化硫的量的测定(二氧化硫可以用碘水来标定),结合元素守恒可以确定黄铜矿的量,进而计算其纯度.
(1)因为称取研细的黄铜矿样品1.150g,精确到小数点后三位,所以用电子天平;故答案为:电子天平;
(2)装置a中的浓硫酸可易吸收空气中的水蒸气,同时根据冒出的气泡的速率来控制气体的通入量;灼热的铜网可以除去多余的氧气;故答案为:b;d;
(3)黄铜矿受热分解生成二氧化硫等一系列产物,分解完毕后仍然通入空气,可以将产生的二氧化硫全部排出去,使结果精确,
故答案为:使反应生成的SO2全部进入d装置中,使结果精确;
(4)根据滴定管的示数是上方小,下方大,可以读出滴定管示数是20.00mL,当达到滴定终点时,二氧化硫已经被碘单质消耗完毕,再滴入一滴碘单质,遇到淀粉会变蓝,根据反应实质,得到:2I2~2SO2~CuFeS2,消耗掉0.05mol/L标准碘溶液20.00mL时,即消耗的碘单质的量为:0.05mol/L×0.02L=0.0010mol,所以黄铜矿的质量是:0.5×0.0010mol×184g/mol×10=0.92g,所以其纯度是:$\frac{0.92g}{1.150g}$×100%=80%,故答案为:80%;
(5)用如图3装置替代上述实验装置d,不能用③,原因是前面通入的空气中也会占据一部分气体体积,所以根据液面上升的高度可以确定生成的量,进而根据元素守恒来确定黄铜矿的纯度,故答案为:②;
(6)空气中的CO2与Ba(OH)2反应可以生成BaCO3沉淀,此外BaSO3被氧化成BaSO4均可以导致所以的沉淀的量比二氧化硫和氢氧化钡反应生成的白色沉淀的量多,
故答案为:空气中的CO2与Ba(OH)2反应生成BaCO3沉淀,BaSO3被氧化成BaSO4.
点评 本题是一道关于物质的百分含量的综合考查题目,考查学生分析和解决问题的能力,难度较大.

| A. | ①② | B. | ①②③ | C. | ①②③④ | D. | ①③ |
| A. | 氨气极易溶于水 | B. | 氨的催化氧化可生成NO | ||
| C. | 氨气可用浓硫酸干燥 | D. | 氨气为无色有刺激性气味的气体 |
| A. | 铜 | B. | 硫酸钡 | C. | 蔗糖 | D. | 醋酸 |
| A. | 上述反应中氯元素被还原 | |
| B. | 上述反应中转移电子的物质的量为15 mol时,消耗3 mol P | |
| C. | 该反应氧化剂与还原剂物质的量之比为6:5 | |
| D. | P2O5是P被氧化后所得的产物 |
| A. | NH3 | B. | SO2 | C. | HCl | D. | O2 |
Ce4++Fe2+→Fe3++Ce3+
Sn2++2Fe3+→2Fe2++Sn4+,
由此可以确定Ce4+、Ce3+、Fe3+三种离子的氧化性由强到弱的顺序( )
| A. | Ce4+、Ce3+、Fe3+ | B. | Ce4+、Fe3+、Ce3+ | C. | Fe3+、Ce4+、Ce3+ | D. | Ce3+、Ce4+、Fe3+ |

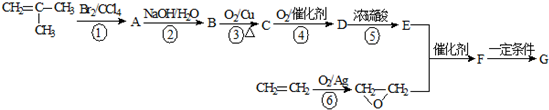
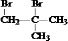 .
.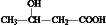 ,
,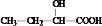 .
.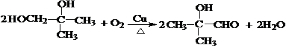 .
.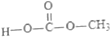 )发生酯化反应而生成的,写出F→G的反应的化学方程式CH2=C(CH3)COOCH2CH2OH+
)发生酯化反应而生成的,写出F→G的反应的化学方程式CH2=C(CH3)COOCH2CH2OH+