��Ŀ����
һ������������ȼ�ϵ�ؾ��и߷���Ч�ʶ��������ӡ�����Li2CO3��Na2CO3�������λ����������ʣ�һ��ͨCO���壬��һ��ͨO2��CO2�Ļ�����壬����650��ʱ������ȼ�ϵ�أ������ܷ�Ӧ��2CO+O2=2CO2��������˵������ȷ���� �� ��
A.ͨCO��һ���ǵ�ص�����
B.�����缫��Ӧ�ǣ�O2+2CO2+4e�D=2CO32�D
C.��������CO32�D�����ʵ����ڹ���ʱ���ֲ���
D.��������������Ӧ
C

��16�֣�����N2��H2����ʵ��NH3�Ĺ�ҵ�ϳɣ������ֿ��Խ�һ���Ʊ����ᣬ�ڹ�ҵ��һ��ɽ���������������ش��������⣺
��1����֪��N2(g)+O2(g)=2NO(g) ��H=+180.5kJ/mol
N2(g)+3H2(g) 2NH3(g) ��H=��92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) ��H=��483.6kJ/mo
����17g��������������ȫ����һ�����������ˮ�������ų�������Ϊ ��
��2��ij����С���о����������������������£��ı���ʼ�����������ʵ�����N2(g)+3H2(g)
2NH3(g)��Ӧ��Ӱ�졣ʵ������ͼ��ʾ����ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�����
��ͼ����T2��T1�Ĺ�ϵ�ǣ�T2 T2������ڡ������ڡ������ڡ�����ȷ������
�ڱȽ���a��b��c����������ƽ��״̬�У���Ӧ��N2��ת������ߵ��� ������ĸ����
������ʼ��ϵ�м���N2�����ʵ���Ϊ molʱ����Ӧ�İٷֺ�������������ݻ�ΪH��n=3mol��Ӧ�ﵽƽ��ʱH2��ת����Ϊ60%����������£�T2������Ӧ��ƽ�ⳣ��K= ��
��3��N2O3��һ�������������������ʺ��Ʊ��ܵ����ǵĹ�ע��
��һ���¶��£��ں����ܱ�������N2O3�ɷ������з�Ӧ��
2N2O34NO2(g)+O2 ��H>0�±�Ϊ��Ӧ��T1�¶��µIJ���ʵ������
| Vs | 0 | 500 | 1000 |
| c(N2O3)/mol��L��1 | 5.00 | 3.52 | 2.48 |
��500s��NO2��ƽ����������Ϊ .
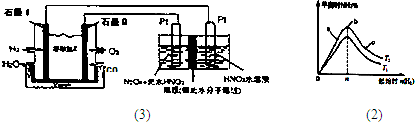
������H2��O2��������Na2CO3��ɵ�ȼ�ϵ�أ����õ�ⷨ�Ʊ�N2O3��װ����ͼ��ʾ������YΪCO2��
д��ʯīI�缫�Ϸ�����Ӧ�ĵ缫��Ӧʽ ��
�ڵ���������N2O3�ĵ缫��ӦʽΪ ��
��16�֣�����N2��H2����ʵ��NH3�Ĺ�ҵ�ϳɣ������ֿ��Խ�һ���Ʊ����ᣬ�ڹ�ҵ��һ��ɽ���������������ش��������⣺
��1����֪��N2(g)+O2(g)=2NO(g) ��H=+180.5kJ/mol
N2(g)+3H2(g)  2NH3(g) ��H=��92.4kJ/mol
2NH3(g) ��H=��92.4kJ/mol
2H2(g)+O2(g)=2H2O(g) ��H=��483.6kJ/mo
����17g��������������ȫ����һ�����������ˮ�������ų�������Ϊ ��
��2��ij����С���о����������������������£��ı���ʼ�����������ʵ�����N2(g)+3H2(g) 
2NH3(g)��Ӧ��Ӱ�졣ʵ������ͼ��ʾ����ͼ��T��ʾ�¶ȣ�n��ʾ���ʵ�����

��ͼ����T2��T1�Ĺ�ϵ�ǣ�T2 T2������ڡ������ڡ������ڡ�����ȷ������
�ڱȽ���a��b��c����������ƽ��״̬�У���Ӧ��N2��ת������ߵ��� ������ĸ����
������ʼ��ϵ�м���N2�����ʵ���Ϊ molʱ����Ӧ�İٷֺ�������������ݻ�ΪH��n=3mol��Ӧ�ﵽƽ��ʱH2��ת����Ϊ60%����������£�T2������Ӧ��ƽ�ⳣ��K= ��
��3��N2O3��һ�������������������ʺ��Ʊ��ܵ����ǵĹ�ע��
��һ���¶��£��ں����ܱ�������N2O3�ɷ������з�Ӧ��
2N2O3 4NO2(g)+O2 ��H>0�±�Ϊ��Ӧ��T1�¶��µIJ���ʵ������
4NO2(g)+O2 ��H>0�±�Ϊ��Ӧ��T1�¶��µIJ���ʵ������
|
Vs |
0 |
500 |
1000 |
|
c(N2O3)/mol��L��1 |
5.00 |
3.52 |
2.48 |
��500s��NO2��ƽ����������Ϊ .
������H2��O2��������Na2CO3��ɵ�ȼ�ϵ�أ����õ�ⷨ�Ʊ�N2O3��װ����ͼ��ʾ������YΪCO2��

д��ʯīI�缫�Ϸ�����Ӧ�ĵ缫��Ӧʽ ��
�ڵ���������N2O3�ĵ缫��ӦʽΪ ��
 ��X��Y��Z�Ƕ�����Ԫ�ص����ֳ��������X��ˮ��Ӧ������һ�־��л�ԭ�ԵIJ��ȶ��Ķ�Ԫ�ᣬ����Ļ�ѧʽ��
��X��Y��Z�Ƕ�����Ԫ�ص����ֳ��������X��ˮ��Ӧ������һ�־��л�ԭ�ԵIJ��ȶ��Ķ�Ԫ�ᣬ����Ļ�ѧʽ��
 Cl(aq) ��H=��72.3 kJ��mol�C1
Cl(aq) ��H=��72.3 kJ��mol�C1
