题目内容
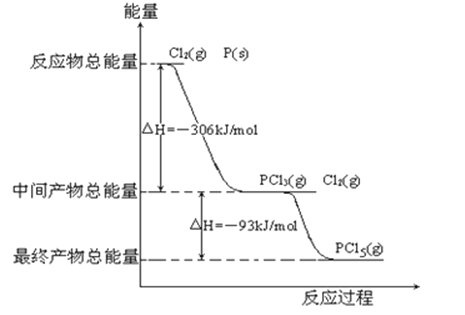
【题目】一种熔融碳酸盐燃料电池原理示意如图.下列有关该电池的说法正确的是( ) 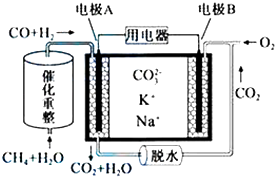
A.反应CH4+H2O ![]() ?3H2+CO,每消耗1molCH4转移12mol电子
?3H2+CO,每消耗1molCH4转移12mol电子
B.电极A上H2参与的电极反应为:H2+2OH﹣﹣2e﹣=2H2O
C.电池工作时,CO32﹣向电极B移动
D.电极B上发生的电极反应为:O2+2CO2+4e﹣=2CO32﹣
【答案】D
【解析】解:A.反应CH4+H2O ![]() 3H2+CO,C元素化合价由﹣4价升高到+2价,H元素化合价由+1价降低到0价,每消耗1molCH4转移6mol电子,故A错误;
3H2+CO,C元素化合价由﹣4价升高到+2价,H元素化合价由+1价降低到0价,每消耗1molCH4转移6mol电子,故A错误;
B.电解质没有OH﹣ , 负极反应为H2+CO+2CO32﹣﹣4e﹣=H2O+3CO2 , 故B错误;
C.电池工作时,CO32﹣向负极移动,即向电极A移动,故C错误;
D.B为正极,正极为氧气得电子生成CO32﹣ , 电极反应为:O2+2CO2+4e﹣=2CO32﹣ , 故D正确.
故选D.

练习册系列答案
相关题目