题目内容
【题目】某课外实验小组从煤油中取出一块钠,用滤纸吸净其表面的煤油,用切刀切下数块,分别进行实验研究:
(1)切下的钠块表面变暗,其反应的化学方程式为________________。
(2)将其中一块钠放入坩埚中加热,反应现象为:________________________,反应的化学方程式是________________________。
(3)过氧化钠是钠的一种重要化合物,其中一种用途是用于呼吸面具或潜水艇中氧气的来源,涉及的主要反应的化学方程式为________________________。若15.6gNa2O2参加反应,则最多可制得标准状况下氧气的体积为________L。
【答案】 4Na+O2=2Na2O 钠块熔化并燃烧,黄色火焰,有淡黄色固体生成 2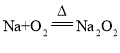 2Na2O2+2H2O=4NaOH+O2↑或2Na2O2+2CO2=2Na2CO3+O2 2.24L
2Na2O2+2H2O=4NaOH+O2↑或2Na2O2+2CO2=2Na2CO3+O2 2.24L
【解析】(1)切下的钠块表面变暗,是因为被空气中的氧气氧化为氧化钠,其反应的化学方程式为4Na+O2=2Na2O。(2)将其中一块钠放入坩埚中加热生成过氧化钠,反应现象为钠块熔化并燃烧,产生黄色火焰,有淡黄色固体生成,反应的化学方程式是2Na+O2![]() Na2O2。(3)过氧化钠能与水及二氧化碳反应产生氧气,因此可用于呼吸面具或潜水艇中氧气的来源,涉及的主要反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑或2Na2O2+2CO2=2Na2CO3+O2。15.6gNa2O2是0.2mol,则最多可制得标准状况下氧气的体积为0.1mol×22.4L/mol=2.24L。
Na2O2。(3)过氧化钠能与水及二氧化碳反应产生氧气,因此可用于呼吸面具或潜水艇中氧气的来源,涉及的主要反应的化学方程式为2Na2O2+2H2O=4NaOH+O2↑或2Na2O2+2CO2=2Na2CO3+O2。15.6gNa2O2是0.2mol,则最多可制得标准状况下氧气的体积为0.1mol×22.4L/mol=2.24L。

练习册系列答案
 开心蛙口算题卡系列答案
开心蛙口算题卡系列答案
相关题目